Approfitto del silenzio degli amici del blog che sembrano intimiditi dal contenuto dell’ultimo post, per continuare il confronto con Neutrino, ormai diventato a senso unico per sua scelta e rifugiato in un blog compiacente che ospita fisici e ingegneri che si occupano di chimica e giullari di fantasia stanca.
Siccome scopo di questo blog è fare debunking chimico in fusione fredda, credo che, dopo avere sottoposto a critica l’articolo di Christian Frønsdal nel post “Neutrino”, sia il caso di dare risalto ad alcune posizioni di Neutrino stesso.
Neutrino, 1° agosto 2014
[Camillo] E’ vittima di se stesso, perché’ alfine se un fisico non deve parlare di chimica perché’ a lui si debba riconoscere la competenza di parlare di un argomento, la metodologia della scienza, che ricade appieno nell’epistemologia e nella sociologia della scienza.
Non credo che tali materie siano insegnate in un corso di chimica …
Meno male, c’è altro da imparare in cinque anni.
Mahler, 29 luglio 2014
La ricerca di misure sperimentali è sempre andata di pari passo con la ricerca di una loro possibile modellizzazione. Cosa ci trova di strano?
Trovo inquietante la posizione di Mahler, che addirittura ritiene che Neutrino stia facendo modellizzazione di dati sperimentali raccolti dagli gnomi della ricerca chimica.
Il prodotto finale delle elaborazioni teoriche di Neutrino è contenuto in questa tavola:
La presentazione dell’equazione si trova in altro commento:
utilizzando solo le grandezza fisiche in gioco (Energia di legane della molecola di idrogeno a 0 K opportunamente riscalata, numeri reali, e = base del logartmo naturale e la Costante dei gas ideali) ed, un unica ipotesi, ben supportata teoricamente dall’articolo che q sia 1.
Tralascio di commentare equazione e presentazione, perché in parte l’ho già fatto nel post “Neutrino”, ma soprattutto perché lascio a Neutrino la possibilità di intervenire e descrivere con maggiore proprietà l’esito della sua fatica.
In tutta franchezza, così com’è ora si può solo definire una mamozio intellettuale senza capo né coda; la chimica interpretata da un fisico.
Per confronto Neutrino può considerare la vera equazione che lega la costante di equilibrio alla temperatura e a un certo numero di grandezze sperimentali.
Se Neutrino desidera riconsiderare tutto con calma, avrà ampia ospitalità nel blog, eventualmente in un post dedicato.



Seguendo un suggerimento di oca, mi sono imbattuto in un’intervista a Silvano Fuso del CICAP. Dice:
In questi giorni cerco di riparare un danno culturale a mio parere provocato da Neutrino.
Fa piacere che Melchior su cobraf abbia lanciato la mia curva di dissociazione dell’idrogeno e perfino la Tabella JANAF da cui deriva. Pochi sapranno utilizzare quella Tabella o sapranno leggere le colonne quattro e cinque, ma almeno vedono quante funzioni termodinamiche sono collegate a una specie chimica, come tags dai quali non si può prescindere se si vuole praticare una chimica razionale fatti di numeri.
Non ci si deve mai scoraggiare, la moneta buona scaccia quella cattiva, nonostante si affermi il contrario. Per questo vale la pena lanciare post anche se non sono commentati.
In una settimana “Neutrino” ha ricevuto 1203 visite, anche se sono mancati i sapidi commenti di Cimpy.
http://www.cobraf.com/forum/topic.php?reply_id=0&topic_id=5747&ps=20&pg=6&sh=0
Un piccolo amichevole appunto: Melchior avrebbe dovuto citare la fonte.
Seguo 1
Seguo anch’io.
@UmmaGumma
Grazie per l’attenzione. Visto che segue il mio blog, mi permetta di risponderLe qui.
In verità si tratta di una faccenda molto più modesta di quello che pensa e descrive. Neutrino ha scritto che non servono dati sperimentali per costruire la curva di dissociazione termica della molecola di idrogeno. Io l’ho contrastato da un punto di vista chimico, per evitare che informazioni scientifiche scorrette arrivassero non tanto a oca sapiens ma a studenti di fisica, che non sono in grado di gestire da soli la questione, dato che hanno a supporto un singolo esame di chimica in tutto il corso di studi. Come avrà capito sono impegnato a fare debunking chimico e non mi potevo concedere di far finta di niente.
Ho colto l’occasione per richiamare l’attenzione sul fatto che i Corsi di Laurea non sono intercambiabili, per cui chimici e fisici potrebbero occuparsi utilmente di fisica e chimica rispettivamente. Quando accade succedono pastrocchi come la buffa tavola di neutrino riportata in questo post.
Il mio è un invito alla modestia e al rispetto delle competenze altrui che, per dei laureati, vanno grosso modo a coincidere con il corso di studi. Sembra pedanteria, ma è per fissare paletti comprensibili per tutti. Ci sono le code della curva di Gauss, ma di queste ci occuperemo quando incontriamo un veterinario diventato premio nobel per la fisica. Per adesso accontentiamoci di mantenerci al nostro livello. E’ un invito che rivolgo soprattutto a me stesso.
Credo di non essermi mai occupato di fisica in vita mia, per non rischiare di essere impallinato alla prima uscita.
So che Cimpy è per le scorribande e le zingarate in campo alieno, ma mi piace anche così, è giovane, è il suo carattere.
@Camillo
Non voglio entrare nella tua diatriba con Neutrino non avendo alcun titolo per farlo, ma potresti pubblicare lo stesso diagramma Ln K contro T ottenuto dai dati sperimentali in modo da poterlo confrontare con quello di Neutrino che hai pubblicato sopra (chiedo scusa se mi è sfuggito o se la richiesta non è sensata).
@Mario Massa
I punti blu sono stati derivati da FermiGas dalle Tabelle JANAF.
Comunque lo faccio senz’altro anch’io.
Abbiamo il diritto di insistere perché spenda qualche parola di spiegazione della sua equazione in questo blog, dove ha potuto esibirsi in totale libertà. Non è accettabile che si nasconda sotto le ali di Oca, che lo tiene sotto tutela. Anche qui dispone della stessa libertà di espressione; contraddirlo, quando è il caso, mi sembra normale dinamica da blog. Non sarà perché si considera un mostro sacro dell’INFN? Comincio a pensarlo.
@Mario Massa
Il grafico derivato dalle Tabelle JANAF è identico (credo, non ho controllato) a quello di FermiGas.

Ora si tratta di confrontarlo con l’equazione di Neutrino,
Spero che nel frattempo Neutrino si sia convinto che il grafico è ricavato da dati sperimentali.
@Mario Massa
Chiunque ha titolo per farlo.
Trovo insopportabilmente arrogante che Neutrino non senta la necessità di spiegare la differenza tra R e R1; perché abbia introdotto nell’equazione il numero di Nepero; quali siano le dimensioni di q…
Avrebbe dovuto spiegare con diligenza e umiltà da dove ha derivato la sua equazione e non l’ha ancora fatto. Ancora peggio, ha cercato e trovato conforto presso oca sapiens che lo coccola come un fisico di riguardo. Al punto da farmi ritenere che esista tra i due un’amicizia personale di vecchia data.
Possibile che nessun laureato abbia il desiderio di capire qualcosa di più di quell’equazione?
@Neutrino
Proprio tu lo chiedi? Sicuramente molto meno dell’INFN. Noi possiamo vantarci di non essere stati tanto sprovveduti da entrare come allocchi nel giro ff italiano, come invece ha fatto l’INFN, dove si stanno ancora leccando le ferite.
Nessuno nel tuo ambiente ha ancora avuto il coraggio di ammettere che si è trattato di una ricerca che ha abbattuto il prestigio dell’INFN. Troppi ricercatori coinvolti per restare indifferenti.
Con la ricerca applicata non si hanno mai sorprese, perché la responsabilità degli esiti ricade sul committente. Da voi è diverso, essendo ricercatori largamente autonomi. Io come ricercatore ho la coscienza tranquilla, ma tu? Che cosa hai fatto per impedire a Celani di spendere male i soldi dello stipendio?
La formula “divulgazione scientifica mediata da debunking chimico” ha avuto successo: ieri ho ricevuto 463 visite.
D’ora in poi, se trovo tempo e voglia, pubblicherò un post ff ogni settimana senza affidarmi ai commenti, che restano comunque graditissimi, purché non siano psicopompismi.
@Camillo
Scusa Camillo, non ho tempo per fare una verifica approfondita o diagrammare in excell la formula di Neutrino, ma provando qualche punto mi pare che il diagramma che hai messo all’inizio del post non sia la curva ottenuta dalle tabelle JANAF come dici, ma proprio la curva di Neutrino.
In particolare si nota che entrambe le curve danno ln = 0 a circa 3500K, ma la curva di Neutrino a 6000K dà un valore di ln K = 6.25 mentre il grafico JANAF dà ln K = 2.8 (circa); a 1000K Neutrino dà ln K = -43, JANAF ln K = -20 con un errore costante di circa 2.2, il chè fa pensare a un errore nella conversione da ln a Log.
Scusa ancora se ti faccio una domanda diretta: la tua accusa a Neutrino è di non avere affatto ricavato la curva per via teorica basandosi su pochi valori sperimentali non dipendenti dal gas analizzato come egli asserisce (e che secondo me meriterebbe un plauso da tutti), ma di avere imbrogliato e aver utilizzato una formula praticamente uguale a quella che avevi postato tu stesso (tratta mi pare da un libro fusionista) alcuni post fa (mi pare in risposta a Gabrichan), aggiustando i valori in modo da far coincidere i risultati con i valori delle tabelle JANAF (commettendo tra l’altro l’errore nella conversione dei logaritmi che mi pare di vedere)?
Ti chiedo questo perchè mi dispiace vedere incrinarsi dei rapporti (in particolare con Ocasapiens) per delle possibili incomprensioni.
Se sono io che non ho capito nulla della vostra diatriba dillo pure apertamente, il pop-corrn mi piace moltissimo e Cimpy dietro la lavagna ne ha sempre in abbondanza.
Buona domenica.
@Mario Massa
Grazie molte per dimostrarti interessato al problema, che secondo me attira molto. Una terza voce autorevole serve moltissimo.
Vediamo come riesce il diagramma excel dell’equazione di Neutrino. Continuo a sostenere che sarebbe stato opportuno far capire lippis et tonsoribus da dove deriva quella roba. Non farlo è arroganza pura.
Nella figura sta scritto:
Dati derivati da FermiGas a partire dalle Tavole JNAF [JANAF, credo]
La mia curva è derivata direttamente dalle Tabelle JANAF, che usano sempre il logaritmo decimale per motivi storici.
Fai bene a tracciare in Excel la curva dell’equazione di Neutrino. Vediamo che cosa ne esce.
Cordiali saluti
@Mario Massa
@Neutrino
Grazie dei link, Neutrino. Aspetto un commento di Camillo prima di dire il mio parere, per quel che può contare, sulla vostra diatriba: è Camillo che afferma che “chiunque ha titolo per farlo” e spero possa aiutare a riconciliarvi.
Per ora ti chiedo:
1 – Il diagramma pubblicato all’inizio del post è relativo alla tua formula riportata all’interno dello stesso diagramma?
2 – I punti blu sono i punti ottenuti da Fermigas partendo dalla tabella JANAF?
3 – Sbaglio nel dire che le due curve sono praticamente coincidenti?
4 – Sbaglio nel dire che c’è un disaccordo (notevole, pari a circa 2.3 volte) tra il diagramma ottenuto dalla tua formula (coincidente con i punti blu di Fermigas) e quello linkato da Camillo relativo ai dati JANAF e che ciò sembra derivare da un errore di conversione Log – ln? (che non c’entra col fatto che un diagramma è dato in Log e l’altro in ln).
@Mario Massa
1) si
2) si tabella postata da FermiGas
3) si entro qualche percento. Il fatto e’ che come FermiGas fa notare si sono trascurati i moti vibrazionali della molecola che danno un contributo ln(a/(exp(-b/T) – 1) dove a e b sono derivabili ( vedi Atkins Physical Chemistry cap 18 lo si puo’ scaricare da rete)
Leggi anche
4) si. L’ uso del log in base 10 sopravvive per motivi storici ma non e’ naturale
@Neutrino
Moltiplicare per una costante non cambia niente.
Bisogna specificare che la curva derivata da JANAF è lo standard cui curve ottenute con altri metodi devono adeguarsi. Perché accettare scostamenti di qualche percento quando esistono le Tabelle JANAF?
Physical Chemistry, in italiano Chimica Fisica, è uno degli esami del Corso di Laurea in Chimica. Non figura nel Corso di Laurea in Fisica.
Se può essere d’aiuto, appena avrò un po’ di tempo io posso spiegare i passi secondo i quali – dalle formule di termodinamica statistica presentate sull’Atkins – sono giunto a una formula del tutto analoga a quella di Neutrino. Può interessare?
@FermiGas
Il tuo aiuto e’ sempre prezioso.
Soprattutto se dopo aver tenuto conto dei modi vibrazioni nella funzione di partizione e la dipendenza di ln k da tali modi si fa vedere come si ottiene l’equazione vera di Camillo, che pero’ non e’ troncata al termine in T^2 essendo uno sviluppo in serie ….
Intanto chiunque può’ studiare pag 601-604 dell’Atkins Physical Chemistry …
@FermiGas
la cosa è possibile solo per un gas ideale dotato di un solo grado di libertà. Per questo ho spostato l’attenzione anche al caso generale di un gas reale, come la dissociazione del tetrossido di azoto. In quel caso si ottengono dati spettroscopici che vengono tradotti in “funzione energia libera” (5^a colonna delle Tabelle JANAF).
@FermiGas
Il tuo aiuto e’ sempre prezioso.
Soprattutto se dopo aver tenuto conto dei modi vibrazioni nella funzione di partizione e la dipendenza di ln k da tali modi si fa vedere come si ottiene l’equazione vera di Camillo, che pero’ non e’ troncata al termine in T^2 essendo uno sviluppo in serie ….
Intanto chiunque può’ studiare pag 601-604 dell’Atkins Physical Chemistry …
Non lo posso scrivere da oca, ma qui sì:
Psicopompo assomiglia a una mosca cavallina. Mai incontrata? Pensare che oca mi aveva suggerito di dargli spazio. Lascio che sia lei sola a gestire Psicopompo.
@Fermigas
“Può interessare?”
Poichè Camillo scriveva: “Secondo me non c’è peggior arroganza che proporre un’equazione senza spiegarla o almeno dire da quale testo proviene.” mi pare fondamentale per potervi chiarire.
@Neutrino
“4) si. L’ uso del log in base 10 sopravvive per motivi storici ma non e’ naturale”
Non è quello che intendevo: nel primo diagramma (il tuo) in corrispondenza, per esempio, di T = 500°C si legge: ln K = -92, mentre alla stessa temperatura in quello di Camillo si legge: Log K = -20 che significa ln K = -46: non è un errore di %. Lo stesso errore (di un fattore circa 2 sul logaritmo) si riscontra su tutta la curva. Non ho avuto il tempo di mettere le due curve su uno stesso diagramma in excell come sperava Camillo, ma se lo fai penso te ne renderai conto.
Ora la domanda è: se la tua curva è ottenuta per via teorica e i punti blu sovrapposti da Fermigas volevano rappresentare la tabella JANAF (quindi ottenuti per via completamente indipendente), perchè hanno lo stesso errore? (ammesso che non sia io a prendere un abbaglio).
@Camillo
“la cosa è possibile solo per un gas ideale dotato di un solo grado di libertà.”
Però se non ricordo male, di questo si stava parlando: mi pare che lo stesso Neutrino avesse detto che ricavare per via teorica casi più complicati era molto più complesso se non praticamente impossibile. Nessuno mi pare metta in dubbio che nella pratica un chimico usa le tabelle sperimentali. Però riuscire a ricavare con buona precisione almeno i casi più semplici per via teorica mi parrebbe molto bello ed elegante. Se Neutrino e Fermigas lo hanno fatto (io non l’ho ancora capito e aspetterei le spiegazioni promesse da Fermigas) mi complimento con loro e credo che se le spiegazioni saranno convincenti, lo farai anche tu, proprio perchè sei un chimico.
@Mario Massa
Scusami ma non avevo capito.
La tabella passatami da FermiGas e’ derivata da JANAF e coincideva con i valori ricavati da Camillo (vedi plot iniziale per il valore della dissociazione nel post NIST-JANAF e i plot generati da FermiGas in https://fusionefredda.wordpress.com/2014/07/10/nist-janaf/#comment-41682 )
Se nell’ultimo plot di Camillo c’e’ un fattore 2 (a parte il diverso lob) credo che Camillo debba trovare un accordo con se stesso.
@Neutrino
L’accordo esiste, la mia curva per α è identica a quella trovata da FermiGas per P = 0,1 MPa.

Attenzione Neutrino, la Tabella JANAF che stiamo usando considera l’equazione:
1/2 H2 —> H
non questa:
H2 —> 2 H
In termodinamica fa differenza.
Trovo poco istruttivo considerare singoli articoli. Se vogliamo insegnare qualcosa ai nostri amici dobbiamo proporre leggi generali. Nel nostro caso la legge generale è questa:
Essa si occupa di tutti i gas reali soggetti a dissociazione termica. Dato che esiste, che cosa si va a cercare? Anche questa è un’applicazione del principio di Occam.
Abbiamo risolto i dubbi di maxwell1961 in modo semplice, diretto e inoppugnabile.
Ogni altro intervento è peggiorativo, come dimostra la semplificazione di considerare ideale anche la molecola di idrogeno. Si può fare quando si è alle strette, ma noi disponiamo delle Tabelle JANAF.
@Mario Massa
Secondo me non c’è peggior arroganza che proporre un’equazione senza spiegarla o almeno dire da quale testo proviene
L’equazione l’ho ricavata da questo articolo
Christian Frønsdal
Heat and Gravitation. III. Mixtures
Fai clic per accedere a 1001.2579v2.pdf
ed e’ identica a quella deviata da Saha
Fai clic per accedere a saha.pdf
Equazione 9 dell’articolo.
Le due derivazioni considerano molecole di idrogeno i cui atomi sono legati rigidamente (4,5 ev per rompere il legame) in equilibrio con idrogeno libero. E’ chiaramente un approssimazione, mancano appunto i modi vibrazioni della molecola di idrogeno ma da risultati abbastanza accurati. Io mi sono limitato nei due casi a rifare i conti per verificare la correttezza delle equazioni ..
Per completezza il primo articolo deriva l’equazione da un principio variazionale di minima azione mentre il secondo dalla scrittura esplicita della funzione di partizione per il sistema. L’equivalenza formale tra la soluzione che minimizza l’azione di un sistema Lagrangiano e il formalismo della funzione di partizione e’ nota grazie alla formulazione sui cammini dovuta a Feynman.
@mario massa
Senza dubbio, sarebbe il capolavoro di FermiGas.
In questo momento mi fa piacere vedere che viene usato un trattato di Chimica Fisica molto noto e usato nel corso di laurea in Chimica. Quindi si resta nel mio campo. Io non ho ritenuto opportuno ricorrere all’Atkins, perché in un caso simile un chimico fa ricorso alle Tabelle Janaf in automatico.
Alla fine di questo confronto resta almeno fissata nelle mente di tutti l’importanza che per un chimico hanno le Tabelle JANAF, di cui certamente molti ignoravano l’esistenza. Perfino Giancarlo le ha confuse con altro. Oca sapiens pensava perfino che potessero essere migliorate con le equazioni di Neutrino.
Aspetto con grande curiosità il lavoro di FermiGas.
Non ricordo di avere letto qualcosa di simile. La sua posizione mi sembra diversa:
Se però da qualche parte riconosce la differenza tra gas ideale e gas reale, prendo atto. Con i gas ideali tutti i santi aiutano.
@Camillo
“Non ricordo di avere letto qualcosa di simile.”
Neutrino, il 17 luglio scriveva:
“parole sante e aggiungo che solo un invasato può pensare di applicare i principi primi a reazioni chimiche un pochino più’ complesse di quella, semplice, che stiamo considerando.
O non si riesce a ricavare soluzioni ragionevoli e se si ricavano non si riescono a risolvere per mancanza di strumenti (analitici e/o numerici) adeguati.”
Secondo me se mettete da parte le polemiche scoprite che in realtà tra voi non c’è disaccordo sostanziale.
@Mario Massa
Solo un disinformato può fare affermazioni simili.
Le Tabelle Janaf prendono in considerazione tutte le sostanze chimiche note e vi appiccicano i tags che hai visto per l’idrogeno elementare. Con quei dati i chimici riescono definire tutto su una reazione chimica, anche inventata lì per lì: se avviene, in quali condizioni avviene, con quali effetti energetici. E solo necessario che reagenti e reattivi siano tabulati.
Per esempio, è possibile ridurre l’allumina con monossido di carbonio? In quali condizioni di temperatura e pressione? La risposta è contenuta nelle tabelle JANAF.
La sola cosa che non può definire è il tempo che serve perché la reazione giunga all’equilibrio, portando il sistema a uno stato di energia minima.
Un fisico non ha gli strumenti per studiare una reazione banale come la dissociazione del tetrossido di azoto, un gas talmente reale che è un vapore. Il chimico questi strumenti li ha. FermiGas ha scritto che CRC dispone di dati analoghi alle Tabelle JANAF. Forse, però vorrei controllare se la collezione di dati termodinamici è abbastanza vasta.
Neutrino ha fatto un grande progresso facendo riferimento a un trattato di Chimica Fisica. Tenendo presente che ci leggono anche studenti, è bene che si sappia che non si devono cercare articoli esotici, ma basta studiare la buona, vecchia Chimica Fisica di scuola. Solo à default si possono cercare articoli esotici, non prima.
Mai rendere complesso un problema semplice. Ci è caduta oca sapiens e perfino Cimpy, temo. Vediamo di riportare tutto ai paradigmi chimici ordinari. Non siamo inventori di nulla, solo modesti utenti del lavoro altrui.
Buongiorno Camillo, ho accettato il suo invito al blog. Le ho già detto che non mi intendo di chimica, quindi ciò che posso fare è contribuire con la mia esperienza.
@Marianna
Benvenuta Marianna. Scriva delle cose che Le stanno a cuore. Ne può nascere un thread che interessa altri. Se non me ne intendo mi limiterò a fare l’amministratore delle vostre conversazioni. Provo immediata simpatia per una persona che si è presentata così bene.
Vorrei raccontare un episodio accadutomi personalmente.
Molto tempo fa avevo una professoressa di chimica che mi dette un voto basso, perché probabilmente infastidita dal senso carismatico che potevo suscitare fra gli studenti.
Dopo ciò il rapporto inter-personale tra me e la prof.ssa peggiorò.
Sarebbe cambiato qualcosa se fosse stata un po’ più “accondiscendente”? Forse.
Ma la mia è una modesta opinione.
@Mario Massa
Grazie, ma e’ inutile.
La questione in esame riflette un disaccordo piu’ profondo e inconciliabile.
Chiunque manipola il reale per farlo coincidere con i propri giudizi a priori non ha il diritto di farlo in nome del metodo scientifico.
A questo aggiungi ignoranza e una buona dose di maleducazione e il gioco e’ fatto.
Cosa distingue un Celani, che vede eccessi di calore dove ci sono solo esperimenti mal condotti, da un Camillo che eleva i suoi pregiudizi sulla metodologia scientifica a sistema universale?
@Neutrino
Se si trattasse di esperimenti mal condotti, basterebbe dargli una mano. Celani viola delle leggi positive di chimica, quindi i suoi esperimenti non possono riuscire. Non vorrei che tu suggerissi di affidare gli esperimenti di Celani a un team di esperti a pagamento che dirimano la questione. Questo è un pericolo incombente da quando sono state lanciate le interrogazioni parlamentari. So che è una tentazione che si presenta in modo accattivante sotto forma di giudizio indipendente. Non fateci lo scherzetto voi Romani.
Mai fare affidamento su un singolo articolo scovato in rete, se non si sono prima consultati tutti i libri di scuola. La rete la consultano solo i disperati, sicuri che comunque un aiutino lo trovano. Era la tecnica irritante di HT. Spero che d’ora in poi farai affidamento esclusivamente su un trattato di Chimica Fisica. Se avviene, avrai il sostegno di tutti i chimici d’Italia.
@Neutrino
Non ti alterare, aspettiamo che FermiGas ottenga la tua equazione in modo autonomo utilizzando un testo di Chimica Fisica. Questo è rassicurante, non fa riferimento ad articoli reperiti in rete per l’occasione.
En attendant potresti almeno spiegarci perché hai usato due costanti diverse R e R1, non si pretende mica un’abiura o la luna. E anche se davvero e nella tua equazione è il numero di Nepero. Cosa ti costa?
Il 1° agosto l’ineffabile Realacci, maturità classica, ha inoltrato il 10° sollecito della sua interrogazione parlamentare sulla ff. Chissà come si stanno muovendo i 5*.
*** Derivazione di ln Kp dalla termodinamica statistica ***
Premetto che, per comprendere questo argomento che mi ha incuriosito, prima ho ristudiato il cap. “Elementi di termodinamica statistica” sul mio Rosati “Fisica Generale I” e poi ho studiato i due capitoli di termodinamica statistica “Statistical Thermodynamics 1: The Concepts” e “Statistical Thermodynamics 2: Applications” sull’Atkins-de Paula “Physical Chemistry”.
Sull’Atkins viene esplicitata la Kp per la generica dissociazione:
X2(g) ↔ 2 X(g) ,
per mezzo delle funzioni di partizione (molecole supposte indipendenti). Nella mia edizione, si tratta dell’equazione (17.57), il cui logaritmo naturale vale:
ln K = -D0/(R T) + ln ( kB T gX^2 ΛX2^3 /(p° gX2 qX2R qX2V ΛX^6) ) , (1)
dove:
D0 = energia di dissociazione del legame a 0 K;
gX = degenerazione dello stato fondamentale elettronico di X;
gX2 = degenerazione dello stato fondamentale elettronico di X2;
ΛX2 = lunghezza d’onda termica di de Broglie di X2;
ΛX = lunghezza d’onda termica di de Broglie di X;
p° = pressione dello stato standard = 1 bar;
qX2R = funzione di partizione molecolare rotazionale di X2;
qX2V = funzione di partizione molecolare vibrazionale di X2.
Particolarizziamo al caso della dissociazione:
H2(g) ↔ 2 H(g) .
D0 è calcolabile coi metodi della meccanica quantistica. In ogni caso, il valore D0/R desunto da Neutrino (51 674 K) è in ottimo accordo con quello calcolabile da JANAF:
ΔG°(0) = 2*216,035 – 0 = 432,07 kJ/mol,
cioè ΔG°(0)/R = 51 966 K.
Ora maneggiamo il logaritmo. Sappiamo che:
ΛX = h/√(2 π m kB T),
ΛX2 = h/√(2 π 2 m kB T),
con m = massa dell’atomo d’idrogeno (1,008 u).
Poiché la temperatura vibrazionale di H2 è 6330 K (come scritto sull’Atkins), assumiamo che i modi vibrazionali siano “disattivati” in tutto l’intervallo d’interesse, ovvero qX2V = 1.
D’altro canto, siccome la temperatura rotazionale ϑR di H2 è 88 K (vd. Atkins), ho attribuito a qX2R la sua approssimazione valida ad alte temperature (però impropriamente estesa a tutto l’intervallo di temperature in esame). Sull’Atkins si dimostra che qX2R ≈ T/(σ ϑR) e che σ, nel nostro caso, vale 2.
A questo punto metto tutto quanto nella (1), vedo che posso portare fuori un (3/2) ln T e dopo un po’ d’algebra trovo che:
ln ( kB T gX^2 ΛX2^3 /(p° gX2 qX2R qX2V ΛX^6) ) =
= (3/2) ln T + ln [ 2 gX^2 (m π)^(3/2) kB^(5/2) ϑR /(p° gX2 h^3) ] . (2)
Siccome poi, nel nostro caso, gX = 2 e gX2 = 1, mettendo i valori nella (2) e facendo le opportune conversioni, alla fine trovo che la (2) numericamente vale:
(3/2) ln T + ln( 6,536 K^(-3/2) ) = (3/2) ln T + 1,877 .
Nell’espressione suddetta si vede che l’omogeneità dimensionale è rispettata (purché T sia espressa in kelvin) e la costante 1,877 è in accordo con quella presentata da Neutrino (1,8111).
Infine, voglio far notare che la funzione K=K(T) così ricavata ha – in linea di principio – bisogno di “poche” e più fondamentali misure sperimentali (cioè mp, me, q, h, ε0), dal momento che tutti gli altri parametri in essa contenuti sono calcolabili (sempre in linea di principio) mediante i metodi della meccanica quantistica.
@FermiGas
Ha fatto un lavoro eccellente, ma ha introdotto una quantità di dati sperimentali; non si tratta di un calcolo esclusivamente teorico.
Può proporci un grafico Log Kp (o Ln Kp) Vs. temperatura?
Così vediamo tutti se le approssimazioni sono accettabili.
Poi si tratterebbe di applicare i calcoli a gas pesantemente reali, come il tetrossido di azoto. Lì non ci sono disattivazioni dei modi vibrazionali a bassa temperatura. La disattivazione sotto 6330 °K fa somigliare la molecola di idrogeno a un gas ideale.
Infine resta da capire perché Neutrino si è mostrato critico nel confronto della determinazione di α attraverso il ricorso delle Tabelle JANAF, da lui ritenuta una determinazione di utilità esclusivamente teorica.
Ha capito perché Neutrino usa R e R1, ed e, numero di Nepero?
In ogni caso, perché accontentarsi di approssimazioni quando sono disponibili le deviazioni dallo stato ideale dei gas reali?
Mi fa molto piacere che sia passato attraverso un trattato di Chimica Fisica e non di Fisica. Senza l’Atkins credo che il Rosati sarebbe servito a poco.
Bravissimo come sempre.
Vorrei capire meglio dove lei pone la linea di demarcazione tra teorico e sperimentale. Supponiamo di voler determinare una grandezza A, abbiamo alcune possibilita’
a) Calcolo matematico puro di A: carta, penna e cestino (eventualmente utilizzando i valori sperimentali di alcune grandezze ‘fondamentali’ tipo m_e, h, e, …)
b) Calcolo matematico con soluzione numerica
c) Simulazione numerica
d) Misura in laboratorio di grandezze ‘non-fondamentali’ B, C, D, … che permettono di risalire ad A tramite A(B,C,D,…)
e) Misura in laboratorio di A
Direi che siamo tutti d’accordo che e) sia sperimentale. Per me, la linea di demarcazione e’ da qualche parte tra c) e d). Mi par di capire che per lei solo a) sia teorico, e a patto di non usare nessun dato che sia stato ricavato sperimentalmente.
Detto questo, senza voler nulla togliere a FermiGas (e all’Atkins), si rende conto, vero, che il calcolo dell’equilibrio partendo dalla funzione di partizione altro non e’ che quello di Saha?
@Briggart
Anche se l’idrogeno ha un comportamento quasi ideale, non ha senso ricorrere a calcoli come quelli di Saha, quando dal 1964 si dispongono delle Tabelle JANAF. Calcoli del genere possono servire solo come esercizio per gli studenti. Qualsiasi altro gas ha un comportamento che si allontana dall’idealità, per cui il metodo Saha non è praticabile in alcun modo. E’ importante che chi ci legge sappia queste cose, specialmente se è studente. Sia chiaro: il metodo descritto da FermiGas in questo blog vale solo per la dissociazione gassosa dell’idrogeno, non per ogni dissociazione gassosa. Resta comunque un metodo approssimato, altra ragione per ricorrere alle Tabelle JANAF.
Camillo Franchini ha detto (5 agosto 2014 alle 9:08 pm):
ma ha introdotto una quantità di dati sperimentali; non si tratta di un calcolo esclusivamente teorico.
Sì, è vero, ho usato dei dati sperimentali, tuttavia parecchi sono deducibili per via teorica. Mediante questo approccio termodinamico-statistico, mi è molto più evidente il legame tra la costante d’equilibrio K e la meccanica quantistica di quanto non lo sia in base alla più nota relazione:
ln K = -ΔH°/(R T) + ΔS°/R .
Infatti, nella precedente eq. (1):
ln K = -D0/(R T) + ln ( kB T gX^2 ΛX2^3 /(p° gX2 qX2R qX2V ΛX^6) ) , (1)
D0, gX, gX2, qX2R e qX2V sono calcolabili risolvendo opportuni problemi di meccanica quantistica, per i quali occorre conoscere – in ultima analisi – il valore sperimentale di mp, me, q, h, ε0; per ΛX2 e ΛX serve poi il valore sperimentale di kB; p° è una costante arbitraria fissata a 1 bar; infine serve anche la misura sperimentale di R. Per questi motivi, sostengo che la (1) ha – in linea di principio – bisogno di poche e più fondamentali misure sperimentali (cioè di mp, me, q, h, ε0, kB, R), in quanto tutto il resto sarebbe deducibile per via teorica.
— —
Può proporci un grafico Log Kp (o Ln Kp) Vs. temperatura? Così vediamo tutti se le approssimazioni sono accettabili.
Ecco, in realtà mi sono accontentato di un veloce confronto numerico con alcuni valori da me precedentemente tabulati. In fondo, la formula che propongo io:
ln K = -51 966/T + (3/2) ln T + 1,877 ,
non è tanto dissimile da quella proposta e già graficata da Neutrino:
ln K = -51 674/T + (3/2) ln T + 1,8111 .
— —
Poi si tratterebbe di applicare i calcoli a gas pesantemente reali, come il tetrossido di azoto. Lì non ci sono disattivazioni dei modi vibrazionali.
I problemi principali che vedo io e che rendono quest’approccio impraticabile dal punto di vista analitico, perfino per certi casi semplici, sono:
1) in un gas reale, le molecole non sono indipendenti. Se voglio tener conto di questo fatto nelle funzioni di partizione, esse diventano sùbito intrattabili per calcoli “amanuensi”. Per esempio, faccio presente che le qT impiegate sono appunto frutto dell’ipotesi di “particelle libere in scatola 3D”.
2) L’espressione estesa, invece che approssimata, di qR è una serie non esprimibile in forma chiusa.
3) L’espressione estesa di qV vale comunque sotto l’ipotesi di approssimazione armonica. Ogni eventuale anarmonicità è trascurata.
Ovviamente, tutto ciò non vieta che si possa validamente procedere con questo tipo di modello termodinamico-statistico per via numerica.
— —
Ha capito perché Neutrino usa R e R1, e, numero di Nepero?
No, non ho approfondito la questione perché mi ero focalizzato sul trovare una strada alternativa.
@Gvdr
Preferisco risponderti qui perché devo aggiungere la scansione di una pagina
Per aiutarti a capire ti propongo l’elenco delle funzioni termodinamiche più usate. Ti renderai conto che la grandezza tempo non figura mai. L’elenco si trova a pag. 683 di
J. A. Campbell
Chemical Systems – Energetics, Dynamics, Structure
W. H. Freeman (1970)
La misura della velocità di variazione dell’entropia di un sistema in evoluzione non può essere considerata una funzione termodinamica. Allo stesso modo si può descrivere la variazione dell’energia libera di un sistema, ma la derivata di G rispetto a t non può essere considerata una funzione termodinamica.
L’equazione [1] non descrive il secondo principio della termodinamica. Il spt è rappresentato in forma sintetica dalla disuguaglianza di Clausius, che dovresti conoscere.
Hai offerto l’occasione per chiarire un punto importante: la termodinamica non conosce la grandezza tempo. Vedo da oca che molti non ne sono a conoscenza.
Preciso che per “leggere” correttamente le equazioni occorre riferirsi alla notazione di Bridgman. In prima battuta si veda:
http://en.wikipedia.org/wiki/Bridgman%27s_thermodynamic_equations .
@FermiGas
… che a sua volta deriva da quella di Maxwell:

@Gvdr
Come avrai notato, nessuna equazione termodinamica contiene la grandezza tempo.
La disequazione di Prigogine mette esclusivamente in evidenza che l’entropia di un sistema isolato si accompagna all’asimmetria del tempo. Ma questo era già implicito nell’enunciato di Clausius che usa il verbo zustreben. Suggerisce che il massimo di entropia di un sistema isolato viene raggiunto attraverso stati intermedi che possono essere di quasi equilibrio e di durata variabile. Al termodinamico interessa che esista la tendenza, non calcola la velocità con cui le trasformazioni avvengono. A questo pensa un’altra disciplina, la cinetica.
Sì, indubbiamente le equazioni derivano delle antecedenti relazioni di Maxwell. Io volevo piuttosto evidenziare che la notazione
(∂T)p = 1
è opera di Bridgman e deriva essenzialmente dall’osservazione che
Cp = (∂H/∂T)p ,
ovvero
Cp / 1 = (∂H)p / (∂T)p ,
da cui arbitrariamente (∂T)p := 1 .
@FermiGas
Capisco l’imbarazzo di Gvdl di fronte a quelle notazioni.
A me interessava mettere insieme tutto l’armamentario della termodinamica classica per dimostrare che di t minuscola non c’è neanche l’ombra.
Ora Neutrino ci spiegherà che invece t si trova nella termodinamica postmoderna che lui conosce, facendo entrare ocasapiens dans tous ses états.
Sono d’accordo per quanto riguarda la termodinamica classica, ma oltre a ciò esiste un’altra branca della termodinamica – detta di “non equilibrio” – in cui la grandezza tempo è fondamentale. Se ne sono occupati perfino Boltzmann (si pensi all’equazione del trasporto di Boltzmann), Duhem (si pensi alla disuguaglianza di Clausius–Duhem nella meccanica del continuo) e poi Onsager, Prigogine e molti altri.
@Neutrino

Nel caso tu abbia dei dubbi, ti informo che l’uso della Termodinamica Statistica è pratica comune in Chimica:
p. 706
J. A. Campbell
Chemical Systems – Energetics, Dynamics, Structure
W. H. Freeman (1970)
Ti faccio notare con malcelata soddisfazione che il lavoro di FermiGas è basato su testi di Chimica Fisica (Tabelle JANAF e Atkins). Nel seminterrato conservo il Rosati; vedo quanto si occupa di termodinamica statistica. Non mi faccio illusioni.
@FermiGas
Siccome Lei, Neutrino, io ci siamo occupati di termodinamica classica, nella quale rientra l’equazione di Neutrino:

esorto a mantenerci in campo, per rispetto di chi ci legge.
Non dimentichiamo che ci stiamo occupando della costante di dissociazione di un gas reale in funzione delle temperatura. Se vogliamo occuparci di altro, cerchiamo di informare gli amici che ci seguono.
Detto altrimenti, se Lei crede opportuno usare altri algoritmi per calcolare una costante di dissociazione gassosa, io stesso sono molto interessato a leggere le Sue osservazioni. C’è sempre da imparare.
Ormai la provocazione è stata lanciata, vediamo come la raccoglie Neutrino.
@FermiGas
Dopo i ripetuti interventi di Gvdr da ocasapiens, serve mettere un punto fermo per evitare disinformazione tra chi segue questo blog. La termodinamica classica non fa uso della grandezza tempo.
Esiste una termodinamica dei sistemi non in equilibrio dove figurano derivate di funzioni termodinamiche rispetto al tempo, ma non fa ancora parte della termodinamica insegnata. Atkins, che aggiorna con cura i suoi testi, non ne fa uso, per quello che ho potuto vedere.
Francamente non mi sembra che le idee dell’ultimo Prigogine si siano affermate. E’ materia ancora magmatica. Finché non viene insegnata conviene essere cauti.
Camillo Franchini ha detto (9 agosto 2014 alle 5:13 am):
La termodinamica classica non fa uso della grandezza tempo.
Questo, per me, è assodato.
— —
Esiste una termodinamica dei sistemi non in equilibrio dove figurano derivate di funzioni termodinamiche rispetto al tempo, ma non fa ancora parte della termodinamica insegnata.
Magari l’architettura generale della termodinamica di non-equilibrio non è largamente insegnata, ma le singole leggi da essa unificate sono ampiamente studiate. Infatti, dalla termodinamica del non-equilibrio discendono le leggi: della propagazione del calore, della diffusione della materia, della cinetica delle reazioni chimiche, degli “effetti incrociati” (termoelettricità, elettrocinetica, termoforesi, effetto Dufour, …) .
@FermiGas
La cinetica delle reazioni chimiche viene associata alla termodinamica classica ed è comunque un argomento gestito dai chimici.
Gli altri argomenti non sono usciti nei giorni scorsi, quindi non serve ricordarli.
Mi sembra che i fisici usino la tecnica del “sì, ma c’è dell’altro”, moltiplicando i temi del confronto. E’ quello che ha fatto Neutrino intervenendo a sproposito nella determinazione di α introducendo approssimazioni che peggiorano il risultato. Giusto per dire “ci sono anch’io”.
Ora si sono buttati nella termodinamica del non equilibrio, materia quanto mai incerta che non è ancora diventata materia d’esame.
Appena ho tempo vedo come viene studiata la termodinamica a Pisa. Al più fa parte del corso di Fisica I e II. Quindi gracilità di preparazione totale.
Camillo Franchini ha detto (9 agosto 2014 alle 1:43 pm):
La cinetica delle reazioni chimiche viene associata alla termodinamica classica
Appunto “associata”, ma in cinetica chimica compaiono variazioni temporali che nella termodinamica classica non sono contemplate. L’anello di congiunzione è proprio la termodinamica di non-equilibrio.
— —
Gli altri argomenti non sono usciti nei giorni scorsi, quindi non serve ricordarli.
Gli altri argomenti servivano solo a illustrare che la termodinamica di non-equilibrio è una teoria più generale, da cui si possono derivare i processi suddetti, partendo da princìpi più generali. Questi concetti più generali non sono altro che il principio di equilibrio termodinamico locale e le equazioni differenziali di bilancio di materia, energia ed entropia.
— —
Ora si sono buttati nella termodinamica del non equilibrio, materia quanto mai incerta che non è ancora diventata materia d’esame.
Tra i cui padri, però bisogna ricordare, si trovano i premi Nobel per la chimica Onsager e Prigogine.
A Messina esiste il corso
http://www.unime.it/didattica/offerta_didattica/_offerta/2013/10046/2010/9999/9206/N0 ,
così come in altre università estere.
@FermiGas
Non è così, in chimica cinetica e termodinamica classica sono strettamente associate. La termodinamica di non equilibrio non viene usata in chimica, per quanto ne so. Serve in altre discipline.

k = rate constant
Farrington Daniels, Robert A. Alberty
Physical Chemistry
John Wiley & Sons (1955) p. 352
Camillo Franchini ha detto (9 agosto 2014 alle 4:52 pm):
Non è così, in chimica cinetica e termodinamica classica sono strettamente associate. La termodinamica di non equilibrio non viene usata in chimica, per quanto ne so.
Dal mio punto di vista, “strettamente” significherebbe che a partire dalle leggi generali della termodinamica classica sarebbe possibile derivare matematicamente quelle della cinetica chimica. Tuttavia, partendo dalla termodinamica classica, ciò non è possibile, visto che essa non contempla la variabile t. Partendo invece dai princìpi della termodinamica di non-equilibrio, ciò si verifica.
La termodinamica di non-equilibrio è una formulazione più generale della termodinamica classica e dire che essa non viene usata in chimica è un po’ come dire che le equazioni di Maxwell non vengono usate in elettrostatica.
— —
Farrington Daniels, Robert A. Alberty
Physical Chemistry
John Wiley & Sons (1955)
La termodinamica di non-equilibrio è una disciplina recente. Se assumiamo le date di conferimento dei premi Nobel (Onsager, 1968 [1]; Prigogine, 1977 [2]) come indicative del riconoscimento di questa nuova branca della termodinamica, è molto probabile che un testo del 1955 non vi faccia riferimento.
[1] http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1968/
[2] http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1977/
@Riccardo Reitano
Io non chi sia né che mestiere faccia, ma direi che è un laureato in fisica come Neutrino. Vi riconosco dal linguaggio standard.
Oggi in tutte le Università italiane viene insegnata la termodinamica chimica che Lei considera obsoleta. Se Lei vuole averne un’idea consulti l’Atkins, il Klotz Rosenberg o il Gerd Buntkowsky Physikalische Chemie 1 – Thermodynamik, la termodinamica chimica di Frederick Rossini, di Samuel Glasstone, di Daniels&Alberty. Dia un’occhiata ai testi consigliati a chi studia termodinamica e si accorgerà in che mondo vive. Se non vuole disturbarsi, basta il Silvestroni.
Lei è caduto nella solita illusione dei fisici di essere in grado di cambiare il mondo, ognuno con la sua ricetta per essere riconoscibile.
Non siamo tutti come oca che si lascia impressionare dai paroloni.
Adelante Pedro, con Juicio.
Pingback: Termodinamica chimico-creazionista, cont. – Ocasapiens - Blog - Repubblica.it
@FermiGas
L’associazione è del tipo espresso dall’equazione:
Ognuno è libero di interpretare se l’associazione è stretta o lasca e di esprimere un giudizio sull’utilità pratica dell’equazione. Onestamente è la sola relazione che conosco, può anche essere pessima; non vorrei esserci crocifisso.
Non vi fa riferimento nemmeno l’Atkins, per citare un testo noto a molti e aggiornato. Nel Daniels & Alberty non ho cercato informazioni sulla termodinamica non all’equilibrio.
Non vedo come questa nuova disciplina possa applicarsi ai casi che abbiamo preso in considerazione. Senza casi concreti da affrontare è difficile capire che tipo di aiuto ci più venire da Prigogine e da Onsager.
Per me è un buon risultato avere fatto capire a tutti che in termodinamica classica non si fa uso della grandezza tempo. Qualche giorno fa c’erano dei dubbi. Piccoli, utili granelli di conoscenza di cui dobbiamo essere contenti.
Da ocasapiens fioccano le critiche; se si tratta di critiche di fisici e matematici che si dilettano di chimica, esse non hanno importanza.
Uno si meraviglia che cerchi di trovare punti in comune affidandomi a trattati e a banche dati; forse preferisce fare come Neutrino che cerca i suoi argomenti navigando in Internet dove si trovano gli articolo di Celani, Rossi e Focardi.
@FermiGas
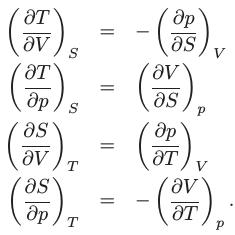
Solo ora noto la simmetria.
Alle quattro equazioni dell’elettrodinamica di Maxwell corrispondono le sue quattro equazioni della termodinamica:
@FermiGas

Nella relazione di Neutrino arrogantemente mai presentata
mi piacerebbe sapere se ε è calore, un’altra forma di energia o cosa.
Ovviamente sarebbe gradita anche una risposta di Neutrino, perché credo che tutti siano interessati.
C. Frønsdal parla di “molecular binding energy”.
Nella mia derivazione, si tratta dell’energia libera di dissociazione a 0 K, che coincide coll’entalpia di dissociazione a 0 K.
@FermiGas
Le condizioni standard sono a 298,15 °K, dove energia libera ed entalpia standard assumono valori diversi. A noi interessa l’entalpia, calore. Sarebbe interessante sapere che calcoli ha fatto Neutrino, ma non si degna di farci conoscere i passaggi dei suoi calcoli. Per aiutarlo concediamogli che si tratti di gas ideali, ma almeno potrebbe farci capire che cosa ha scritto. Lei ha colto la differenza tra R e R1, per dire?
Ora si è rifugiato da oca e può permettersi di non rispondere perché qua non legge più. Che modi.
@ocasapiens
Non so chi sia Claudio, ma hai citato la più grande sciocchezza di questi ultimi giorni.
La termodinamica di non-equilibrio non è per niente una formulazione più generale della termodinamica classica, è solo un complemento, talmente poco importante che non viene mai riportato nei trattati di Chimica Fisica e di Termodinamica Chimica. Non ci vuole molta fatica per controllare. Fin che si ritiene che la termodinamica classica fa uso della grandezza tempo, si arriverà sempre ad esagerazioni del tipo che hai riportato.
FermiGas,
colpa mia, la prego di scusarmi.
@Camillo
Non riesco a capire qual è l’argomento di fondo di questa discussione…
1) Interrogarsi sulla matematica alla base di un prontuario di dati tabulati?
2) Comprendere se ha più strumenti per comprendere a fondo la termodinamica chimica un fisico o un chimico?
3) Affermare con forza le rispettive visioni di metodo scientifico?
Il fatto è che, qualunque di quelle risposte precedenti fosse quella giusta, personalmente non riesco a non trovare mille volte più interessante il precedente dibattito sul secondo principio della termodinamica (ma anche gli altri dibattiti precedenti).
A meno che il focus della discussione non fosse un altro – ma allora vorrei capire di che si tratta…
Saluti
@Mahler
Il confronto è nato con Neutrino sulla dissociazione termica dell’idrogeno; poi si è esteso a Gvdr, che si meraviglia che il tempo non figuri nella termodinamica classica.
Neutrino ha tenuto vivo il confronto con affermazioni del tipo:
Lei aggiunge:
Anche questo è importante; trovo metodologicamente scorretto ricorrere ad articoli scovati in rete per affrontare problemi di validità generale, come se la scienza non si fosse fornita da tempo di tutti gli strumenti necessari. Prima si fa ricorso a trattati di valore riconosciuto poi, se si è disperati, si fa ricorso ad articoli. Esattamente quello che ha fatto FermiGas, che si è affidato esclusivamente alle Tabelle JANAF e al trattato di Chimica Fisica di Atkins.
Il metodo di Hermano Tobia e di Neutrino è da respingere con fermezza, perché porta solo a frammenti di conoscenza, quando va bene; più spesso a disinformazione, come nel caso di Frønsdal, cui ho dedicato il post “Neutrino”.
Credo che, a parte quelli che si interessano solo alle vicende di Rossi, molti abbiano trovato interessante il confronto, a giudicare dal numero di contatti, anche dall’estero.
Dato che si chiama termodinamica chimica giudichi Lei.
Qualcuno ha scritto che i fisici imparano un po’ di termodinamica chimica per l’impegno personale di certi professori di chimica del primo anno. A giudicare dagli interventi non si direbbe proprio.
Caro Camillo,
ti rispondo solo perché mi tiri in ballo con pesantezza.
La discussione nostra non è *mai* stata confinata alla sola termodinamica classica. Quei confini li hai aggiunti, a cose fatte ed unilateralmente, tu. La nostra discussione partiva dal tuo appoggio forte e spensierato all’affermazione (di M.) per cui, parafrasi mia, ” la seconda legge della termodinamica prevede che le Dolomiti saranno scomparse *in qualche milione di anni*”. Quando ti ho chiesto conto di quel “qualche milione di anni” tu, senza notare alcuna contraddizione col tuo appoggio, mi hai risposro che “il tempo è sconosciuto alla termodinamica” e che “nessuna equazione della termodinamica contiene la variabile tempo”. Nessun accenno alla termodinamica classica.
Io ti ho mostrato un testo di Prigogine in cui la variabile tempo c’era.
Avresti potuto almeno avvisarmiin quale momento avessimo cominciato a parlare solo di termodinamica classica. Magari non avrei citato proprio Prigogine e ti avrei dato ragione.
Così, invece, mi pare solo che tu stia cambiando le carte in tavola solo per poter dire “ho ragione io”.
@Gvdr
Questa è appunto termodinamica classica.
No, il testo diceva solo che l’entropia aumenta in un sistema isolato; nessun’altra informazione.
Scusa, perché ti interessi di termodinamica se fai il matematico? E’ molto rischioso uscire dal proprio campo di competenza.
1) Ti rendi conto, vero, che sostieni sia l’atemporalità della termodinamica classica (giustamente) e che una previsione temporale (“qualche milione di anni”) faccia parte della termodinamica classica?
2) Non ti capisco: sei, di nuovo, tornato a sostenere che su quel testo di Prigogine non figuri il tempo o stai sostenendo che quella non è una espressione valida della SLT per sistemi isolati?
P.s. Io non mi occupo di termodinamica classica, e son ben contento di ascoltare chi ne sa di più. Mi stavo occupando di una “previsione” geologica, fatta da un antidarwinista usando malamente la tua amata termodinamica chimica (malamente perché è stata usata proprio per fare una previsione temporale). Mi interessa di più l’entropia, che come sai non è solo quella di Clausius, ma fa parte della matematica, almeno dalla versione di Shannon in poi…
@Neutrino
L’ho fatto nel post “Neutrino”.
@FermiGas
Una disciplina in evoluzione? non credo proprio. Ecco cosa si scrive sulla termodinamica classica:
Ivan P. Bazarov, “Thermodynamics” (1964)
Ritenere che la termodinamica di non-equilibrio sia uno sviluppo logico e necessario della termodinamica classica mi sembra un atteggiamento troppo audace.
La chimica rientra completamente nel campo di applicazione della termodinamica classica. La chimica, quindi un enorme campo di applicazione, forse il più importante, fa esclusivamente uso della termodinamica classica. Se vuole controllare può cercare anche altri testi di termodinamica chimica o di chimica fisica diversi dall’Atkins.
Certamente il lavoro di Boltzmann portò un importante contributo alla teoria del trasporto elettronico e alla fisica dei plasmi, ma introdurre la termodinamica di non-equilibrio in un blog dove si fa debunking chimico crea solo confusione e dà agli sprovveduti la sensazione che “c’è dell’altro da sapere”. Onsager e Prigogine son certamente importanti, ma la chimica si fa sulle Tabelle JANAF.
@FermiGas

La termodinamica classica consente di fare delle cose molto eleganti:
La pendenza della curva fornisce il valore – ΔH°/R per la reazione di dissociazione dell’idrogeno.
A proposito: Lei finora ha applicato solo termodinamica classica; finché si occupa di Chimica non si illuda di ricevere informazioni utili dalla termodinamica di non-equilibrio.
@Gvdr
Sono due cose distinte.


1. La termodinamica non introduce il tempo in tutte le sue equazioni.
2. Dato che in sistema isolato l’entropia può solo aumentare si può immaginare una relazione che consenta di stabilire di quanto l’entropia aumenta nell’unità di tempo.
Una relazione del genere non fa parte della termodinamica.
La situazione è descritta qui:
Accusa ingiusta per chi conosce la materia: il “qualche milione di anni” era solo un argomento logico, non un’indicazione temporale basata sulla geologia o su misure. E’ lo stesso errore in cui è incorsa oca. Vi perdete in dettagli insignificanti. Così Masiero vi infilza tutti in allegria.
Hai fatto male a mettere insieme Clausius e Shannon.
1.1) Insisti a ribadire l’ovvio, dopo che ti è stato detto non essere quello l’argomento della discussione. Non mi sono mai sognato di negare l’applicabilità della termodinamica classica al sistema terra, tantomeno al sistema universo. Non mi sono mai sognato di negare la morte termica. La frase in oggetto prevedeva una previsione temporale. Tu, ignorando la previsione temporale, dici che la frase è corretta. Hai ragione. Concordi sul fatto che non ignorando quella previsione temporale la frase è scorretta?
1.2) Mi pare, di nuovo, scorretto la tua generalizzazione: la termodinamica classica non usa la variabile tempo. La termodinamica di non equilibrio, Prigogine (quello ho citato), la usa. Possiamo dirci d’accordo su questo?
2) Il “milione di anni” non era un “argomento logico” (qualsiasi cosa un chimico possa intendere con “argomento logico”, lasciamo la logica ai logici :-p). Semmai poteva essere una figura retorica. Tutti quelli che l’han letto, a parte te, non hanno colto alcuna licenza poetica nell’autore della frase. Questo punto mi pare opinabile e ognuno può rimanere sulla sua posizione.
3) Non ho “messo assieme” Clausius e Shannon, facevo riferimento a due diversi concetti, che si presentano con lo stesso nome. Non esiste solo l’entropia della termodinamica classica. Esiste anche l’entropia della scienza dell’informazione, e quella della meccanica quantistica ed altre ancora. Pur diversi, vi sono punti di contatto e parallelismi fra tutti questi concetti, molto interessanti per giunta.
@Gvdr
La previsione temporale deve essere intesa come “arriverà un momento in cui le Dolomiti non esisteranno più”. Arrestarsi puntigliosamente sulla previsione temporale è un tentativo di ridicolizzare Masiero.
Il 2 agosto Oca sapiens sapiens scrive:
E’ un tentativo autolesionista di ridicolizzare Masiero, non riparato in nessun commento. Tutto è nato dallo sfondone di oca, anche la termodinamica non all’equilibrio, introdotta al solito per allargare il discorso e buttare tutto in vacca.
Nemmeno per sogno. Hai citato un’espressione di Prigogine di termodinamica classica, la variazione dell’entropia rispetto al tempo in un sistema isolato, che tutti conosciamo. Hai usato quell’espressione per affermare che la termodinamica classica introduce il tempo nelle sue equazioni. Ti ho scandito tutte le equazioni delle termodinamica classica per mostrarti che non esistono derivate rispetto al tempo. Che altro serve.
La figura retorica riguarda la grammatica. Quei “milioni di anni” indicavano un tempo indeterminato che nessuno, nemmeno i geologi, si è mai sognato di prevedere. Oltretutto bisogna fare i conti con le forze orogenetiche che lavorano in senso opposto.
Per me sotto c’è un accanimento nei confronti di Masiero, che mi sembra sia antipatico a tutti presso oca. Una volta o l’altra cercherò di capire chi è e cosa fa. Anche Pennetta non mi sembra trattato meglio. Per rispetto a oca cercherò di capire chi sono e cosa fanno.
Spero che non ti venga la tentazione di introdurre Shannon. Nicholas Georgescu-Roegen ha introdotto la termodinamica anche in economia. Anche lì c’è la sua brava entropia.
Lasciando a dopo il come quella frase vada interpretata, sei d’accordo o no che interpretandola letteralmente è scorretta?
“Hai citato un’espressione di Prigogine di termodinamica classica, la variazione dell’entropia rispetto al tempo in un sistema isolato, che tutti conosciamo. Hai usato quell’espressione per affermare che la termodinamica classica introduce il tempo nelle sue equazioni. Ti ho scandito tutte le equazioni delle termodinamica classica per mostrarti che non esistono derivate rispetto al tempo.”
A me pare vi sia una contraddizione fra le seguenti due frasi:
1) “la variazione dell’entropia rispetto al tempo” di Prigogine è una espressione di termodinamica classica, 2) Nelle equazioni della termodinamica classica “non esistono derivate rispetto al tempo”.
A meno tu non stia riferendoti alla differenza fra “espressione” ed “equazione”, non capisco come tu stia conciliando 1) e 2). Se il problema è quello, allora basta seguire il testo di Prigogine fino ad equazione, ad esempio (2.3) nella pagina seguente, dove Prigogine introduce la produzione di entropia per unità di tempo come somma su tutti i processi p di J_p * X_p (rates of irreversible process * corresponding generalized forces).
P.S.
No, la previsione temporale non deve essere intesa per forza come l’hai intesa tu, che per tua stessa ammissione non sai nemmeno di chi parli e non hai alcun elemento in più di me per interpretare quella frase.
No, le figure retoriche non riguardano solo la grammatica.
No, non stavo introducendo Shannon. Stavolo solo notando che concetti simili esistono in materie differenti (per la terza volta tocca ripeterlo!).
@Gvdr
Bella scoperta per ripeterla tre volte. Non fare come Psicopompo moderno.
Risponderò appena trovo il tempo.
Bella domanda, per ripeterla tre volte!
@Gvdr
Come accade tipicamente tra chi non è del mestiere, si è scatenata un’infatuazione per la non-equilibrium thermodynamics, considerata l’ultima novità che svecchia o addirittura supera la termodinamica di Gibbs, quella delle Tabella JANAF.
Ho fatto una mia personale ricerca, che appena posso prolungo, e ho scoperto che essa non esiste nemmeno per un altro grande classico della termodinamica chimica, il Klotz Rosenberg del 2008.
Io conservo l’ottimo testo di Klotz del 1964.
Sta capitando come per la ff, si attribuiscono con leggerezza potenzialità straordinarie a discipline che si considerano risolutive. In genere gli entusiasti sono cultori di altre discipline. Oca sapiens sta sostituendo 22 passi. Tifosi al posto di esperti.
@Gvdr
La 2.3 è una relazione che appartiene alla termodinamica di non-equilibrio. Lo spiega chiaramente Prigogine stesso:

Scrive “once this assumption is accepted”; la premessa è che bisogna accettare l’ipotesi. Prigogine parte deciso verso la termodinamica di non-equilibrio.
Esistano discipline, come la biologia, che fanno uso delle strutture dissipative; certamente non la chimica.
Per espressione intendo “frase”. La frase è la seguente:

… the entropy S, which increases monotonically until it reaches its maximum at the state of
thermodynamic equilibrium.
La
non fa parte della termodinamica classica, puoi controllare.
La 2.3 non è una relazione. Dunque, secondo il suo modus operandi, non leggo nemmeno il resto. Si studi “Algebra”, Serge Lang, 1955.
Camillo Franchini ha detto (10 agosto 2014 alle 8:59 pm):
Una disciplina in evoluzione? non credo proprio. Ecco cosa si scrive sulla termodinamica classica
Parlavo di “termodinamica” in generale, non di termodinamica classica. Avrei potuto dire la stessa cosa della “fisica” in generale, non della fisica classica.
— —
(10 agosto 2014 alle 11:28 pm)
finché si occupa di Chimica non si illuda di ricevere informazioni utili dalla termodinamica di non-equilibrio.
Se è vero che la termodinamica di non-equilibrio è inutile alla chimica, perché sono stati assegnati due premi Nobel per la chimica inerenti lavori sulla termodinamica di non-equilibrio?
La termodinamica di non-equilibrio determina delle relazioni matematiche generali fra l’entropia, scompensi di grandezze intensive e flussi di grandezze estensive.
La chimica non fa forse uso di grandezze intensive? Non fa forse uso di grandezze estensive?
— —
(10 agosto 2014 alle 8:29 pm)
Lei ha colto la differenza tra R e R1, per dire?
La prima è la costante universale dei gas, la seconda è la costante dei gas specifica (e riferita al gas d’indice 1).
@FermiGas
E’ inutile alla chimica di cui ci stiamo occupando, la chimica descritta nelle Tabelle JANAF.
Alcuni testi di chimica recenti descrivono i lavori di Onsager, ma solo come scoperte marginali.
Per esempio
Eric Schneider & Dorion Sagan
Into the Cool, Energy Flow, Thermodynamics, and Life
The University Chicago Press (2005)
dedica in appendice 4 pagine ai “Principles of Open Thermodynamics Systems” e descrive il “linear regime” di Onsager.
E’ interessante sapere che “minimum entropy production is seen in steady-state chemical systems and in thermal conduction when the heat reaches a steady state along the length of the system”, ma si tratta di una situazione di scarso interesse pratico.
Non conosco trattati recenti di Chimica Fisica che si occupino delle termodinamica di non-equilibrio. L’Atkins del 2006 non riporta il fenomeno nell’indice alfabetico. Evidentemente la considera del tutto marginale. Non riporta nemmeno i nomi di Onsager e Prigogine.
Non bisogna perdere il senso delle proporzioni, ed evitare che fenomeni marginali soverchino quelli consolidati. Evitare soprattutto che gli studenti considerino la termodinamica non all’equilibrio uno sviluppo logico e conseguente della termodinamica classica, una sorta di sua modernizzazione.
Meglio lasciare a oca sapiens sapiens e a Neutrino atteggiamenti outrés e avanguardisti. In chimica poi… oca è laureata in storia/filosofia, Neutrino in fisica. Non c’è da preoccuparsi.
@FermiGas
Cos’è la costante dei gas “specifica”? R è una costante universale, non esiste una R1.
Chiediamo a Neutrino, che si sottrae sistematicamente quando gli si chiede di spiegare i suoi parti scientifici.
@FermiGas
Mi permetta un rimbrotto amichevole …
Lasci a Camillo la fatica di capire l’articolo che ha criticato …
@FermiGas
Vorrei ricordare che le Tabelle JANAF sono la sola banca dati che riporti le funzioni termodinamiche dell’idrogeno atomico fino a 6000 °K; la CRC si ferma a 1500 °K. Se si vogliono fare calcoli fini di termodinamica chimica si deve fare ricorso alla Tabelle JANAF, non c’è alternativa.
@Gvdr

Credo che sarebbe utile per tutti vedere se ritrovi presso qualche altro autore la relazione di Prigogine:
Lo chiedo, perché potrebbe indurre altri a ritenere che il tempo entra nelle funzioni termodinamiche.
Si decida a mettere in ordine il suo vocabolario. Funzioni, espressioni, equazioni, relazioni son quattro cose diverse. Quella di Prigogine non è una relazione!
“il tempo entra nelle funzioni” non ha alcun significato matematico. Cosa significa?
Non dica “termodinamica” quando intende più strettamente “termodinamica chimica classica” e non accetta null’altro a parte quest’ultima.
Non dica “presso qualche altro autore” quando intende più strettamente “in un libro di testo scritto da un chimico ed usato nei corsi di Laurea in Chimica delle facoltà italiane” e non accetta null’altro.
Insomma, applichi a se stesso gli stessi parametri che impone agli altri.
@Neutrino
L’ho detto fin dal mio primo intervento: nella termodinamica classica il tempo non c’è, lo sanno tutti tranne i laureati in fisica:


Non sei abituato a essere contraddetto, vero Neutrino?
“Non sei abituato a essere contraddetto, vero Neutrino?”
Mi pare in buona compagnia..
@shineangelic
Non è in buona compagnia, perché io non mi offendo mai. I contrasti su argomenti scientifici non possono generare ostilità seria. Si tratta sempre di tempeste in un bicchiere d’acqua. Mi infuria molto di più Zichichi, se scopro che ha fatto un uso disinvolto del denaro pubblico. Reciprocamente non credo che Neutrino prenda cappello se scrivo che non capisce un accidente di termodinamica chimica.
Non è complicato per un fisico non capire un accidente di termodinamica chimica.
In compenso non so come funziona un TV Samsung Full HD, dove sicuramente Neutrino è maestro.
Mi pare in malafede, Dr.Franchini. Avevo scritto “contraddetto”, non “offeso”. Ci mancherebbe. Se dovessi proprio essere così irriverente, le chiederei se è vero che un fisico le ha portato via la fidanzata quando frequentava l’università. Solo in quel caso, o pochi altri (tipo la calura estiva), saprei giustificare la deriva di toni, argomentazioni ed interesse di questo blog. Partito con ottime premesse e frequentatori, si è avvitato su inique discussioni che odorano astiosamente di sfida personale.
@Neutrino
Non riesci ad allontanarti dalle tue conoscenze frammentarie e mal collegate.
L’appiattimento delle delle Dolomiti sconcerta te come Oca. Vedi che cosa accade al Sole secondo P. Davies (Gli ultimi tre minuti):
Oppure, se preferisci la teoria dei Cicli cosmologici:
In tutto questo lento appiattimento, vuoi che le Dolomiti restino in piedi da sole?
Scrivi:
Il Secondo Principio della Termodinamica si applica a TUTTI i sistemi, tranne i micro.
Einstein scrive:
@Camillo Franchini
Effettivamente la Termodinamica è pura geometria differenziale, ed il parametro temporale è indifferente. L'”equazione” per la produzione di entropia,
P=dS/dt &ge 0 (1)
non deriva però da una nuova teoria “estesa” a cui viene aggiunto il principio di equilibrio locale; tale principio seleziona semplicemente i sistemi a cui è applicabile direttamente la formula, che sono fortunatamente i più comuni (fluidodinamica, teoria dei reattori a flusso continuo, ecc si basano sostanzialmente su questa proprietà).
Affinché valga la (1) è sufficiente che la dinamica del sistema obbedisca ad una Master Equation; il teorema H di Boltzmann è un chiaro esempio di questo fatto.
I tentativi di estendere la termodinamica agli stati di non equilibrio sono stati molteplici: termodinamica “razionale” di Coleman, termodinamica “generalizzata” di Prigogine, approccio mesoscala di Rubì, … Tutti con pretese di universalità, ma poi applicati solo ad alcuni insiemi specifici di sistemi termodinamici. Prigogine ha tentato di “geometrizzare” la termodinamica dei sistemi di non equilibrio, ma il tentativo ha funzionato solo nel regime lineare (in questo ambito limitato la produzione di entropia P parametrizza gli stati stazionari); da questo punto di vista, l’approccio di Prigogine ha fallito, nel senso che pare proprio non esistere un funzionale che parametrizzi gli stati stazionari di non equilibrio arbitrariamente lontani dall’equilibrio. La natura sembra dirci: fuori dall’equilibrio, liberi tutti, ognuno per sé.
Si noti che anche la ben fondata Termodinamica non è immune dall’introduzione di principi di selezione impliciti che ne limitano il campo di applicabilità: per esempio, la termodinamica come scritta da Gibbs non è applicabile ai sistemi autogravitanti senza incorrere in paradossi.
Devo ammettere che noi fisici abbiamo la tendenza a considerare la termodinamica come il capitolo 1 del libro di meccanica statistica; ed in meccanica statistica il tempo does matter.
Un panorama disincantato della questione può essere trovato nel libro “Termodinamica” di S. Carrà.
Però non capisco: come entra tutto questo nella disputa sulla dissociazione della molecola di H?
Saluti
@Valerio Peralta
Non c’entra per niente, perché la dissociazione termica delle molecole di idrogeno è trattata dalla termodinamica chimica.
Neutrino, fisico, ha voluto dire la sua sull’uso delle Tabelle JANAF e ne è nato un ping pong che deve avere confuso non pochi studenti. Gvdr ha peggiorato notevolmente le cose affermando che la termodinamica classica, chimica e non, prevede l’uso della grandezza tempo e cincischia sulla differenza tra relazioni, equazioni e non so cosa, senza citare un solo autore diverso da Prigogine. Sembra non conosca un solo testo di termodinamica da introdurre nel confronto.
Non servono opinioni personali, servono citazioni da trattati universitari, i soli che siano oggetto di ferreo screening da parte di docenti e studenti.
Mi fa piacere che conosca S. Carrà. Io ho usato un suo testo di Esercizi di Chimica, scritto insieme a G.Favini. Molto utile.
Qualcuno scriverà che S. Carrà è troppo vecchio.
Nel suo “Termodinamica” non trova certo la grandezza tempo.
Ma anche questo confronto è utile, perché almeno gli studenti si rendono conto che la termodinamica classica è senza tempo… in tutti i sensi.
Non immaginavo che esistesse questo equivoco sul tempo.
Lei è in malafede, Camillo!
Mi citi il passaggio in cui io avrei asserito che “la termodinamica classica prevede l’uso della grandezza tempo” o ritiri quella frase.
E non è certo colpa mia se lei non sa distinguere fra relazioni ed equazioni!
@Gvdr
Vediamo di capirci.


Io affermo che questa proposizione di Prigogine:
significa che la l’entropia di un sistema isolato può solo aumentare: può restare costante se le trasformazioni che avvengono all’interno del sistema sono reversibili.
Si tratta cioè di una proposizione di termodinamica classica.
Aggiungo di mio che la derivata rispetto al tempo di qualsiasi funzione termodinamica comporta l’uscita dalla termodinamica classica.
In questo senso la relazione di Prigogine
genera l’ambiguità che L’ha tratta in inganno.
Per questa ragione ho invitato Lei e Oca sapiens di trovare altri testi in cui questa espressione, o altre derivate rispetto al tempo di funzioni di stato termodinamiche, sia presente.
Se Lei prendesse l’abitudine di sviluppare le Sue considerazioni in un solo blog, sarebbe più facile seguirLa. Io mi sforzo di riportarLa qua, ma Lei preferisce la dolce sicurezza che Oca Le offre.
Per l’ennesima volta: la 2.1 non è una relazione. La smetta di maltrattare la matematica.
@Camillo Franchini
Ho l’impressione che la querelle sul tempo in termodinamica nasca da un semplice problema di demarcazione delle materie: i sistemi in equilibrio locale sono pertinenza della termodinamica? Secondo alcuni autori sì (S. Carrà è tra questi) e molti anni fa uscì un articolo su Le Scienze intitolato proprio “La Dinamica della Termodinamica”, in cui si cercava di fare chiarezza sulla faccenda; tanto per dire, l’articolo era scritto da un appartenente ad una scuola concorrenziale rispetto a quella di Prigogine (mi pare fosse B. Lavenda, ma potrei sbagliarmi).
Se si aggiunge che la termodinamica è vista in alcuni testi come una sorta di prolegomeni alla meccanica statistica, in cui il tempo ha un suo ruolo, gli ingredienti per una discreta confusione ci sono tutti. Il “Termodinamica” di Carrà contiene e.g. anche molte bellissime parti di meccanica statistica … mentre in “Equilibrium and Non-equilibrium Statistical Mechanics” di R. Balescu (scuola Prigogine) si trova una esposizione della termodinamica di rara chiarezza e profondità.
Saluti
@Neutrino
Ti rispondo citando il mio vecchio Klotz (1964):
“classical thermodynamics deals only with the properties of matter in bulk (e.g., pressure, temperature, volume, electromotive force, magnetic susceptibility, heat capacity). Its fundamental principles can be formulated without any recognition of the existence or properties of molecules; it is a phenomenical science.”
C’è un seguito sulla termodinamica statistica che vi risparmio perché lo conosciamo tutti.
Il sasso dal punto di vista dinamico risponde alla esigenza termodinamica di ridurre la sua capacità di compiere lavoro; per questo tende a cadere nella buca più profonda possibile. Un sistema, aperto, chiuso isolato, tende a rendere nulla la sua energia libera.
Anche i legami chimici presenti nel sasso tendono a renderlo un sistema dal quale si ricava il minimo di energia chimica.
Sono fuori tema, ma trovo l’attuale discussione non proprio interessante…
Forse l’argomento è già stato trattatato, ma io l’ho perso.
Cosa ne pensate dell’esperimento di Don Borghi?
Qualcuno sostiene di averlo ripetuto con successo.
http://arxiv.org/abs/physics/0608229
Ah! trova l’attuale discussione noiosa? E perchè mai la legge?
Ad ogni modo con Don Borghi credo abbia bussato alla prta sbagliata. Se scorre indietro troverà sicuramente dove viene detto senza mezzi termini che si tratta di pura Fuffa.
Credo potrà trovare maggiori soddisfazioni su pagine dove la Fuffa trova ampio spazio e riconoscimento es. 22Passi o EnergeticAmbiente.
@shineangelic
E’ chiaro che si tratta di una sfida personale, anche dura, ma non c’è niente di male, trattandosi di una sfida su un argomento scientifico aperta a tutti.
Ho capito che si trattava di una sfida quando Neutrino ha considerato le Tabelle JANAF una pedestre raccolta di dati adatta ai ragazzi dell’Istituto Fermi di Roma.
Si trattava di una ghiottoneria che non poteva essere trascurata, un invito a nozze.
Ma solo da Oca sono permalosi come vergini oltraggiate; qua nessuno se la prende, perché tutti sanno che psicopompi e querulomani non sono graditi.
Pingback: Quiz per i giullari – Ocasapiens - Blog - Repubblica.it
@Camillo
Le lancio un assist. Sarebbe tutto più elegante se dicessimo: «L’equilibrio del “sistema Dolomiti” è rappresentato dalla loro scomparsa».
Ma non solo la termodinamica classica non ci dice “quando”, ma non ci dice neanche “se” tale equilibrio verrà mai raggiunto (esistono infatti gli equilibri metastabili – di cui, chissà, magari anche le Dolomiti faranno parte – e nessuna legge ci dice che questi debbano essere mai rotti – a meno che non si applichi la scimmia instancabile al principio d’indeterminazione su un tempo infinito per tutti i sistemi macroscopici).
L’eleganza di questa disciplina sta proprio nel suo rapporto profondo con il concetto di equilibrio – ma questa non solo non si occupa del quando, ma neppure del se.
Come tutte le branche della scienza anche la termodinamica classica ha le sue implicazioni filosofiche e le sue sfumature esistenziali, in grado di suscitare discussioni belle e profonde (perché non parliamo ad esempio della Civiltà eterna di Dyson come scappatoia esistenziale al Secondo Principio? O del rapporto tra termodinamica e decoerenza? O tra termodinamica e gravità?). Solo che ricordo che è sempre stato lei a mettere in riga chi partiva per la tangente con discussioni epistemologiche (compreso il sottoscritto). Perché adesso sembra che non riesca a smettere di fare filosofia della scienza? Che le è preso?
Il problema degli “sprovveduti” in questo momento (tra cui mi infilo tranquillamente anch’io) non è tanto se si chiedano se ci sia altro da sapere, quanto piuttosto che si staranno chiedendo «debunking di cosa»?
Saluti
@Mahler
La termodinamica non conosce se. Ciò che avviene in un sistema isolato è ineluttabile: massima entropia, zero energia libera, eliminazione di qualsiasi gradiente. Gli stati metastabili sono solo temporanei, poi vengono superati.
Le sembra filosofia della scienza? Si tratta di banale debunking in campo chimico. Gli interventi di Oca sapiens sapiens, di Neutrino e di Gvdr hanno consentito di eliminare molti malintesi di termodinamica chimica. Sono convinto che molti hanno apprezzato i nostri sforzi.
Sarebbe già un ottimo risultato avere eliminata la tentazione di considerare i lavori di Prigogine e Onsager lo sviluppo logico e conseguente della termodinamica classica.
Visto che Celani non pubblica più, vale la pena estendere i nostri interessi.
@Camillo
La sua affermazione tratta di un argomento non banale. Se un sistema non ha disponibilità dell’energia di soglia necessaria per abbattere gli equilibri metastabili, questi non si abbatteranno e il sistema è indisponibile a produrre ulteriore lavoro (= massima entropia), nonostante “in teoria” potrebbe.
Se per abbatterli invece utilizza le fluttuazioni statistiche in un tempo infinito, beh, allora sappia che in un tempo infinito la stessa scimmia instancabile avrà rimesso dentro la boccetta l’inchiostro sparso nella bacinella d’acqua, spontaneamente e nonostante questo stato non costituisca un equilibrio.
Occhio ché a mettere di mezzo il se si inceppa in paradossi: io mi limiterei ad affidare alla termodinamica classica il qual è l’equilibrio?.
Il quando e il se sono davvero argomenti più profondi.
Saluti
@Mahler
Se davvero l’Universo sarà ridotto a neutrini, fotoni, elettroni positroni, vuol dire che gli stati metastabili saranno stati superati. Avranno dato del filo da torcere, ma non credo che siano gli stati metastabili il problema.
E’ sempre convinto che ci stiamo occupando di filosofia della scienza? A me sembra ottima termodinamica. Alla fine di un corso di termodinamica questi argomenti vengono sempre trattati, anche se non fanno parte dell’esame. I sistemi isolati sono molto suggestivi.
@oca sapiens
Mi fa piacere che abbia accettato la sfida.

Credo però che tu consideri la termodinamica come una sorta di fluidodinamica, alla quale si possono applicare equazioni che descrivono la velocità di trasferimento dei fluidi. A dispetto del nome, la termodinamica non si occupa esclusivamente del trasferimento di calore.
Qualcuno ha proposto di definire “energetics” la termodinamica classica, per mettere in evidenza che essa si occupa di ogni tipo di trasformazione energetica.
In nessun testo di termodinamica trovi le rispettabili equazioni di Fick, Darcy, Fourier, perché la termodinamica non deve essere confusa con la fluidodinamica. Storicamente nessuno dei tre scienziati è considerato un termodinamico.
Ti ricordo che le funzioni delle termodinamica classica sono queste:
Ricordo che il mio trattato di Fisica Tecnica sottoponeva a considerazioni termodinamiche anche la tensione superficiale. Peccato che ho prestato il Trevissoi a un collega che non me l’ha restituito.
Non per voler apparire prudente, ma non escludo che la termodinamica di non-equilibrio faccia uso di derivate rispetto al tempo. E’ una materia che non conosco; ciò che conosco è che appare solo come appendice di scarso rilievo nei trattati di termodinamica moderna.
Apprezzo il tuo impegno e il tuo amore per la termodinamica, disciplina supremamente elegante.
@Camillo Franchini
Il teorema di minima produzione di entropia non dovrebbe essere considerato un argomento marginale da appendice, visto che sta alla base, per esempio, del calcolo degli stati stazionari dei reattori chimici a flusso continuo usati negli impianti industriali. Una volta era argomento dei testi di chimica fisica applicata, ma trovo che possa trovare dignitosissima collocazione in un testo di Termodinamica…
Saluti
@Valerio Peralta
Forse ha ragione, devo pensarci.
Mi ha sbalordito la competenza in fisica di Oca Sapiens. Se però le chiedessi perché non si può ridurre Al2O3 con CO come si riduce Fe2O3, forse non saprebbe rispondermi; in compenso conosce alla perfezione le equazioni di Fick, Fourier, Darcy.
L’ho capito da questo blog: tutti conoscono la fisica alla perfezione, anche i letterati; nessuno conosce la chimica. Non posso che lamentarmene. In Francia la situazione deve essere anche più sbilanciata che da noi. Misteri dell’insegnamento scientifico.
Ora devo uscire, mi piacerebbe capirci di più.
@Giancarlo
Il mio parere coincide con quello di Atkins:
Thermodynamics is silent on the rate at which a spontaneous change in fact occurs, and some spontaneous processes (such as the conversion of diamond to graphite) may be so slow that the tendency is never realized in practice whereas others (such as the expansion of a gas into a vacuum) are almost instantaneous.
“Rate” significa variazione di una grandezza rispetto al tempo.
Oca Sapiens ha proposto alcune equazioni differenziali dove figura il tempo; hanno però il difetto di non essere equazioni di termodinamica.
Se esiste una dozzina di equazioni termodinamiche dove figura il tempo, dovresti proporcene almeno sei.
Credo che ne esistano nella termodinamica di non-equilibrio ma, finché non compaiono in qualche trattato, preferisco aspettare un po’ a dare loro credito. Come la termodinamica, io non ho fretta. Mi pare che Onsager e Prigogine siano presentati come dei coraggiosi outsider, che trovano qualche difficoltà ad affermarsi. Valerio Peralta ha chiarito bene la situazione. Non mi sembra che possano sostituire Clausius o Gibbs.
Per quanto riguarda Shannon, non credo che possa essere inserito in questo contesto. Del resto non si tratta di termodinamica ma di una applicazione particolare dell’entropia, una delle funzioni della termodinamica; ce ne sono altre.
Non è indicato l’autore della voce sulla Treccani. Non sarebbe meglio servirci di trattati universitari, un pochettino più estesi e più affidabili?
@Camillo
Ho acceso il ferro da stiro e si è comportato esattamente come avevo calcolato in base al primo principio della termodinamica. Ossia la piastra ha raggiunto la temperatura di equilibrio con l’ambiente esattamente nel tempo da me calcolato con tre metodi diversi (entro il 2%). Nelle mie equazioni il tempo c’era. L’evoluzione della temperatura pure. E il ferro da stiro si è dichiarato d’accordo. L’unico in disaccordo mi pari tu.
Le equazioni sono nel link da me proposto alla Treccani. Siccome sono figure conviene che le posti tu e le commentiamo tutti insieme. Paragrafo 8 della Treccani.
@Giancarlo
Dobbiamo occuparci di termodinamica leggendo 3 pagine delle Treccani? Fossero almeno chiare.
Leggo per esempio:
Devo ritenere che questa relazione non fa parte della termodinamica classica?

“nat” significa “naturale”, trasformazione spontanea, irreversibile.
Questa relazione si trova su tutti i trattati di termodinamica chimica.
Tu conosci il trattato di Chimica Fisica dell’Atkins, riferiamoci a quello.
Rilancio: in tutto il capitolo dedicato alla termodinamica chimica non esiste una sola derivata rispetto al tempo.
Atkins ribadisce:
Aggiungo che la potenza delle termodinamica chimica sta proprio nell’indipendenza dal tempo delle sue funzioni di stato. Le informazioni che posso estrarre dalle Tabelle JANAF sono facilmente utilizzabili. Se voglio sapere se l’idrogeno può reagire con l’ossigeno consulto le Tavole JANAF che mi rispondono che la reazione è possibile. Non mi danno però alcuna informazione sul tempo necessario affinché un litro di ossigeno reagisca con due litri di idrogeno in condizioni standard.
E’ possibile che le ricerche di Onsager e Prigogine cambino la situazione. Vedremo. Intanto è prudente attenersi ai trattati che accennano a quei ricercatori solo per completezza di informazione. Nemmeno sempre.
@Giancarlo
C’era perché non si trattava di equazioni termodinamiche.
La termodinamica era comunque presente perché ha imposto che il rendimento della trasformazione elettricità —> calore sia del 100 %. Se tu avessi voluto usare il gradiente termico ferro da stiro – temperatura ambiente per produrre energia elettrica ci saresti riuscito, però con un rendimento modesto.
Il carbone bruciato per produrre elettricità ha contribuito ad aumentare l’entropia dell’universo più velocemente che se fosse rimasto in miniera.
Anche Oca Sapiens ha fatto considerazioni simili alle tue, citando equazioni che sembrano di termodinamica perché riguardano le modalità con cui il calore viene trasferito da un corpo a un altro. La termodinamica fa molto di più, si occupa delle trasformazioni di energia da una forma all’altra. E’ in grado di stabilire quanto calore si ottiene se si bruciano due litri di idrogeno con un litro di ossigeno. La reazione può essere immediata se provocata da una scintilla o lenta come si desidera se essa viene realizzata in pila. Se avviene in pila la termodinamica stabilisce quanta energia elettrica può produrre. Viene calcolata anche la variazione di entropia del sistema e di quella dell’universo. In nessuna delle equazioni usate, compresa quelle di Nernst che descrive la pila, figura il fattore tempo.
Un ciocco di legno produce lo stesso calore sia se viene bruciato in camino sia se viene lasciato ossidare in campagna per via batterica in presenza di acqua. L’importante è che la mineralizzazione del ciocco porti agli stessi composti. La ragione è che l’entalpia è una funzione di stato, è sufficiente conoscere lo stato iniziale e quello finale di un sistema; i processi intermedi possono essere ignorati. Anche il tempo necessario alla mineralizzazione viene ignorato.
Quando l’orogenesi sarà cessata in seguito all’esaurimento dell’energia tettonica, le Dolomiti saranno in possesso di energia potenziale gravitazionale che sarà destinata a svanire, come sono destinati a svanire i gradienti di materia e di energia. Riduzione dell’energia gravitazionale significa livellamento delle Dolomiti. Come dice giustamente il Prof. Masiero, il livellamento delle Dolomiti è imposto dalla termodinamica.
@Ivodivo
Ho dato un’occhiata al sito di Pennetta. Ho trovato gravemente obiettabili le considerazioni di Masiero contenute in “4 piccoli misteri della biologia molecolare classica”; varrebbe la pena di dedicarci un post. Io però non ci penso, mi bastano le Dolomiti e Fick, promosso termodinamico perché si occupa delle dinamica del calore.
@oca sapiens
Un po’ di storia.
Fourier, nato nel 1772
Fick, nato nel 1829
Darcy, nato nel 1803
Rudolf Clausius, nato nel 1822
Solo Clausius si è occupato di Termodinamica nel senso moderno del termine.
Gli altri non ci pensavano proprio.
Per quanto riguarda Onsager e Prigogine, aspetta che figurino nella prossima edizione della Chimica Fisica di Atkins. Per adesso ne sono vistosamente esclusi. Non fare il passo più lungo della gamba.
Comunque complimenti per avere una preparazione in fisica così seria. Autodidatta?
@Giancarlo
Per evitare di cadere in qualche colossale incomprensione tra noi, riporto un passaggio da un testo di termodinamica elementare.
Nobile-Mastrorilli
Se su questo punto siamo tutti (anche oca sapiens) d’accordo, ogni altro disaccordo cade.
Le Tabelle JANAF servono soprattutto a stabilire se una reazione è termodinamicamente possibile in determinate condizioni sperimentali. E’ solo un primo passo, perché si deve successivameente stabilire se la reazione avviene in un tempo ragionevole. A questo punto interviene la cinetica chimica.
L’indifferenza al tempo della termodinamica chimica si manifesta drammaticamente nell’assenza della variabile tempo in tutte le relazioni di termodinamica chimica.
@Claudio Della Volpe
“Ovviamente” è un avverbio che non si usa mai in un contesto come questo. Quello che per Lei è ovvio può non esserlo per altri.
In quali trattati di uso corrente presso le Università il tempo ha trovato collocazione corrente nella termodinamica? A Pisa la termodinamica si insegna come vent’anni fa. Si riferisce alla Sua Università?
“Una sua collocazione” è un’espressione che fa venire in mente che il “tempo” è entrato dalla porta di servizio. Non è escluso che venga cacciato. Dica la Sua liberamente ma non sia impaziente. La termodinamica accademica è ancora quella di Atkins, di Klotz-Rosenberg e delle Tabelle JANAF.
Ciao Camillo e buon ferragosto a tutti (si fa per dire, visto il tempo).
Mi riaffaccio con una fugace visita, per segnalare una curiosità che interesserà sicuramente tutti coloro che hanno seguito l’argomento storico di questo blog e che riguarda anche l’ultima diatriba che sta colmando da qualche tempo il vuoto di notizie relative al filone principale.
E’ uscita la classifica annuale Ranking Shangai dei primi 500 atenei al Mondo (1).
Nella classifica generale i nostri atenei si piazzano dal 150 posto in poi.
Il migliore è risultato quello di Bologna, che è stato anche l’unico a piazzarsi nella fascia delle prime 50 università in una delle classifiche di disciplina. Ciò è avvenuto proprio grazie alla sua facoltà di fisica, che è riuscita ad agguantare il 50° e ultimo posto disponibile nella prima fascia (2).
In tutte le altre discipline, chimica compresa (3), c’è il vuoto.
L’istituto diretto dal Prof. Capiluppi è quindi la nostra attuale avanguardia accademica.
(1) http://www.repubblica.it/scuola/2014/08/16/news/nessun_ateneo_italiano_in_top_150_bologna_la_migliore-93918568/?ref=HREC1-10
(2) http://www.shanghairanking.com/SubjectPhysics2014.html
(3) http://www.shanghairanking.com/SubjectChemistry2014.html
Ciao, Ascoli65.
Mi sorge un dubbio: non è che queste posizioni in classifica sono come certe bandiere blu assegnate a lidi balneari posti presso le foci dei fiumi?
@ Cimpy,
qualsiasi classifica incorpora necessariamente diversi errori di valutazione che tuttavia sono solitamente di segno opposto e mediamente si elidono a vicenda. La posizione di classifica del DF di Bologna è ottima: il 50° posto nel mondo è di tutto rispetto e significa che ne fanno parte ottimi professori, con una buona preparazione e ben coordinati. Ciò è vero oggi, come lo era 4 anni fa. Il che conferma, come ho spesso sostenuto in passato, che anche nel 2011 essi NON potevano NON sapere che l’accrocchio NON funzionava (1). Questo suscita l’interrogativo sul perchè abbiano lasciato per almeno un anno che il nome del loro dipartimento e di tutta l’UniBo venisse impiegato per sostenere la campagna mediatica a sostegno del fuzionamento dell’apparato Rossi-Focardi e dalla sua imminente commercializzazione.
Speriamo che alla ripresa dell’attività parlamentare, il MIUR, rispondendo alle incalzanti sollecitazioni dell’On. Realacci sulla FF, avrà la compiacenza di rivelare le vere ragioni di ciò che è avvenuto nelle nostre istituzioni scientifiche più prestigiose.
(1) https://fusionefredda.wordpress.com/2014/05/22/hermano-tobia/#comment-39175
@Ascoli65
Bentornato Ascoli.
Non si sa se mancano informazioni perché ormai Passerini si disinteressa della ff o se proprio non esistono. Fino a poco tempo fa Passerini viaggiava per l’Italia per fotografare e intervistare i più importanti ff; sapeva tutto con grande anticipo; RAI e privati facevano a gara per intervistare e filmare i più noti protagonisti ff. Ora è calma piatta. Morte termodinamica della ff o l’argomento è venuto a noia?
@ Camillo,
probabilmente perfino Passerini ha capito che è stato preso in giro dai titolari ufficiali della conoscenza scientifica. Non possiamo imputargli la colpa di avergli prestato fede, è ciò che avrebbe fatto qualsiasi cittadino che si fida delle istituzioni, comprese quelle scientifiche. Semmai gli si può rimproverare il modo un po’ troppo guascone con cui se n’è fatto portavoce.
Io lo lascerei tranquillo nel suo silenzio.
Non è da lui che attendiamo giustificazioni e relative scuse: UBo maior, minor cessat.
@Camillo
A me pare che si stia parlando di filosofia invece che di scienza.
Anch’io ho studiato una termodinamica senza tempo e concordo con te che si possa svolgere un corso universitario senza mai menzionarlo. Molti autori sono d’accordo con te, compreso Atkins che tu citi. Io però vedo il tutto come una sorta di difesa del pelo nell’uovo e di semplici definizioni. E’ chiaro che se la tua termodinamica è senza tempo la devi affiancare con un corso che potremmo chiamare “Trasmissione del calore e della massa”. E’ esattamente quello che accadeva ai miei tempi in cui la termodinamica del Sette o del Silvestroni era affiancata dalla Termodinamica all’interno della fisica tecnica (si chiamava proprio così, termodinamica), e imparavamo a progettare scambiatori di calore.
E’ chiaro che il primo principio per un sistema chiuso (regione di massa fissata) lo puoi scrivere come dE=Q-W dove dE è la variazione dell’energia immagazzinata, Q il calore netto trasferito al sistema e W il lavoro netto compiuto dal sistema; è chiaro che in questa versione si può ignorare il tempo, magari andandosi a prendere una pizza mentre tutto arriva all’equilibrio finale.
Però, il primo principio lo puoi anche definre così:
The rate of increase of thermal and mechanical energy stored in the control volume must equal the rate at which thermal and mechanical energy enters the control volume, minus the rate at which thermal and mechanical energy leaves the control volume, plus the rate at which thermal and mechanical energy is generated within the control volume.
Qui il tempo c’è e il problema del mio ferro da stiro è risolto. Vogliamo proibire l’inserimento di questa versione del primo principio in un corso di termodinamica? Troppo tardi. Lo hanno già fatto in molti con buona pace dell’Università di Pisa, che come nota Ascoli non figura nei primi 150 atenei del mondo.
Buon Ferragosto in ritardo a tutti.
PS Leggo saltuariamente il blog per via delle vacanze.
@Giancarlo
scrivere
dE = Q – W
è molto importante perché viene messo in evidenza che dE è un differenziale esatto, mentre non lo sono Q e W.
Dalla tua definizione questo non risulta. Perché usare tante parole mentre pochi simboli son sufficienti? Sapere che dE è un differenziale esatto serve per definire dH, dS, dG, dA.
Anche il ciclo di Carnot, che interessa gli ingegneri più dei chimici, non considera il tempo.
La termodinamica chimica ha dimostrato di essere uno strumento potentissimo per lo sviluppo della chimica, per questo è materia per un singolo esame del corso di chimica. Lasciateci lavorare come piace a noi.
Stanno provando a introdurre il tempo, ma i risultati sono ancora gracili. Aspettiamo la prossima edizione di Atkins, non c’è fretta.
Atkins insegna a Oxford, immagino che Oxford sia ben piazzata nella classica.
No, si tratta di scienza, si chiama “termodinamica chimica”.
Franchini se ha voglia mi spiega una cosa, Lei giustamente dice che la componente tempo non ha importanza in chimica, mi chiedevo ma il tempo non influisce sulla resa di una reazione, cosa molto importante in chimica.
Se faccio reagire delle sostanze queste si ricombineranno, ma il risultato finale quanta prodotto avrò ottenuto e quante saranno le variazioni termiche di calore ed energia queste dipendono dal tempo in cui viene lasciata reagire la reazione.
Faccio un piccolo esempio, se butto un’aspirina effervescente in acqua e bevo subito il contenuto del bicchiere non mi farà un bel niente, perché la pastiglia non si è sciolta, devo aspettare un po di tempo per farla sciogliere prima di berla perché faccia effetto.
PS. qualche giorno fa ho comprato un prodotto omeopatico per una amica, sulla confezione c’era scritto:
Medicinale omeopatico
senza indicazioni terapeutiche approvate
…
…
…
Medicinale non a carico del servizio sanitario nazionale.
Ma la carina e simpatica farmacista mi ha chiesto se volevo detrarlo…. e che si può
scaricarlo dal 730 ????
la cosa mi ha lasciato abbastanza stupito.
@Gabrichan
Mi fa piacere rispondere alle Sue domande, perché Lei rappresenta non solo se stesso ma anche altri – fossero solo dieci persone – che hanno il diritto di capire come funziona la chimica.
La componente tempo non figura in termodinamica chimica ma ha importanza in chimica. Una reazione lenta è di scarsa utilità, specialmente nella chimica industriale delle grandi sintesi. Bisogna pertanto fare in modo che una reazione sia insieme termodinamicamente possibile e veloce nella sua realizzazione. A volte bisogna arrivare a dei compromessi, per avere le due cose insieme.
Mi affido a un esempio.
La sintesi dell’ammoniaca consiste nella reazione d’equilibrio
N2 + 3 H2 ↔ 2 NH3
Consultando le Tabelle JANAF e facendo qualche calcolo, si trova che dal punto di vista termodinamico la reazione dovrebbe essere condotta a bassa temperatura e ad alta pressione. Da un punto di vista cinetico una temperatura elevata favorisce il raggiungimento dell’equilibrio. Si arriva a un compromesso tra termodinamica e cinetica facendo avvenire la reazione a temperature intorno a 600 °C in presenza di un catalizzatore e sottraendo dall’equilibrio l’ammoniaca prodotta.
La termodinamica non dà informazioni sul tempo necessario al raggiungimento dell’equilibrio; la cinetica non dà informazioni sul valore della costante di equilibrio a qualsiasi temperatura. Termodinamica e cinetica devono essere considerate insieme in modo indipendente.
Alcuni hanno l’impressione che io trovi inopportuno che si faccia ricerca sulla minimizzazione della produzione di entropia in certi processi. Io la penso come Valerio Peralta; è giusto fare ricerca, ma è anche giusto riconoscere che per ora i risultati sono del tutto marginali e controversi. Che non abbiano ancora raggiunto i trattati di Termodinamica la dice lunga sullo stato di avanzamento della non-equilibrium thermodynamics . L’ultima edizione dell’Atkins è del 2006.
Ha scelto un esempio interessante.
La termodinamica stabilisce che l’aspirina effervescente deve sciogliersi, indicando anche l’effetto termico che l’accompagna. Non dà però nessuna indicazione sul tempo che serve per la dissoluzione. La cinetica si occupa del tempo di dissoluzione.
Buona giornata.
Grazie Franchini, chiaro e conciso come sempre.
@gabrichan
Se le leggi non sono cambiate rispetto a qualche anno fa la risposta è sì.
Anch’io vendo pozioni dell’amore composte di acqua e zucchero e vorrei chiedere a questo Stato in crisi di farsene carico come come con l’omeopatia, a chi mi devo rivolgere?
Bo…. forse alla lobby delle case farmaceutiche.
Una delle spiegazioni dell’omeopatia è la memoria dell’acqua ma se sono commercializzati come dei grani di zucchero di acqua non c’è ne… e addio memoria.
L’effetto placebo ha un’efficacia su tutte le malattie con un’incidenza di circa il 20% che è molto di più di alcuni farmaci specifici, e il fatto che si usi lo zucchero per me non è un caso, il cervello è molto sensibile al glucosio.
Se poi si prende il “medicinale” pensando alla patologia che dovrebbe curare e lo si associa ad un buon sapore ne verrà rimarcato l’effetto come un ancora, tutte le volte che si mangerà qualcosa di dolce sarà come prendere il medicinale o presunto tale.
Le pozioni d’amore sono il business del 21° secolo mi dai la ricetta? 🙂 grani di zucchero arricchiti con acqua attivati con serotonina 🙂
omeopatia (…) memoria dell’aqua(…) effetto placebo
Ciao, GabriChan
Da Sylvie Renato ti fa delle scuse
Confesso di averci messo lo zampino, ma solo per fargli leggere meglio il tuo messaggio. Poi mi sono accorto che la parte sullo zucchero non l’avevo letta bene neanch’io e mi è venuto anche un dubbio: lo zucchero è perché il cervello ne è sensibile per una questione di gusto,dico bene? O intendevi sensibile a prescindere (magari perché lo consuma anche lui) e il gusto è un plus?
Cimpy ho risposto di la, è una questione di gusto, si associa ad una sensazione fisica un’emozione.
Chi ha davvero voglia di guarire guarisce nella metà del tempo, è un dato di fattoe ad influenzare questa cosa è sicuramente lo stato d’animo della persone, le emozioni che prova.
Giancarlo, dato che non so come scriverti privatamente, provo a farlo qui, se la evidente patologia del gestore del blog me lo lascerà fare…
Credo sia evidente a tutti che il problema non è un dettaglio tecnico sulla termodinamica (che però non si chiama termostatica 😛 ) ma è invece nel modo di considerare lo sviluppo scientifico, la possibilità di nuove scoperte rispetto a quanto è conosciuto, il ruolo di conferma ma non assolutistico dei data-base e delle tabelle ufficiali rispetto a possibili intuizioni innovative e di come queste possono essere validate…
E’ un discorso spesso implicito in tante discussioni, ma secondo me è questo il problema che si sta affrontando ora tra questo blog e quello dell’oca…
La tendenza alla chiusura mentale di Franchini è uno dei problemi principali, che ha portato a questa specie di sciopero nel postare su questo blog, innescato dalle esagerazioni davvero esecrabili nei riguardi di Neutrino, che a mio parere ha sostanzialmente ragione nella disputa, una volta che si chiariscano davvero i limiti che ognuno mette all’uso di termini comuni.
Per cui ti chiedo, alla luce dei tuoi rapporti amichevoli con Camillo Franchini, di cercare di fargli capire, privatamente, i suoi molti errori e specialmente che non può sperare di gestire ulteriormente questo blog se non la smette di essere assolutamente tetragono ad idee diverse da quelle che ha capito dai suoi libri di scuola…
Scusa del modo dell’intervento, e poiché ovviamente Franchini legge e potrebbe anche non pubblicare questa mia esternazione, spero di sentire una tua risposta…
Ciao
Michele Castellano
@Mikecas
Il mio impegno è occuparmi di debunking chimico. Il blog è nato per questo.
Il modo più efficace e meno personale per ottenere un risultato è fare riferimento a trattati di Chimica Fisica e di Termodinamica Chimica noti e aggiornati. Il modo meno efficace è di esprimere posizioni personali come fa Neutrino.
Lei può scegliere altri approcci per fare debunking fisico, ma difficilmente avrà successo.
Come chimico non sono interessato al consenso di fisici e ingegneri, perché è normale che ci sia uno sfalsamento importante nelle nostre conoscenze; mi interessano molto più i contatti che il blog attira, davvero lusinghieri.
Considero però stimolanti le osservazioni di tutti, indipendentemente dalla competenza di chi le esprime.
Pingback: Il cattivo maestro – Ocasapiens - Blog - Repubblica.it
@Claudio Della volpe
Atteggiamento borioso, da ganzetto. Atkins non è per niente un testo del primo anno; viene adottato in molte Università come trattato di riferimento di Chimica Fisica. Anche a Parma, dove ci rinvia premurosamente oca sapiens sapiens:
http://farmacia.unipr.it/cgi-bin/campusnet/corsi.pl/Show?_id=15b4
Nella parte introduttiva delle Tabelle JANAF non c’è il minimo accenno al tempo. Dobbiamo sgridarli?
Facile criticare quando si scrive da oca sapiens sapiens circondati da giullari che trasformano tutto in frizzi e lazzi.
Siete sicuri di essere contattati o vi divertite tra voi come i seminaristi?
“Facile criticare quando si scrive da oca sapiens sapiens circondati da giullari che trasformano tutto in frizzi e lazzi.”
le critiche sono arrivate anche qui, ma lei è sordo. Inoltre si comporta come un cieco.
“Siete sicuri di essere contattati o vi divertite tra voi come i seminaristi?”
Della Volpe avrà anche fatto il ganzetto, ma la sua risposta inutilmente piccata (ci divertiamo tra noi dai tempi del Galantini report, se è per quello) fa capire che sta rosicando. Spiace, come quando il contrabbasso rivolto ai tre violini afferma: “siete calanti!”
Riveda l’accordatura e vedrà che la gente torna. Le regole non scritte del web non le decide lei e neanche il modo “più efficace e meno personale per ottenere un risultato”.
O forse sostiene che la conclusione prematura della presidenza INRIM abbia le radici su questo blog?
@shineangelic
Esatto, la critica del piezo è cominciata in questo blog. Il piezo fu presentato qui da Armando de Para ed ebbe un seguito pressoché immediato. A Cardone e Carpinteri ho dedicato dei post prima di chiunque altro. Era un tema nucleare, non interessava nessuno.
A Lei cosa risulta? Forse Ugo Bardi scrisse qualcosa, non ricordo.
A me non interessa che la gente torni, se si tratta di tifosi. A me importa che uno studente di chimica possa leggermi senza provare imbarazzo o restare disorientato. Per questo ho trovato interessante la contestazione sgangherata a Masiero. Era una buona occasione per mettere in chiaro che cosa si può chiedere alla termodinamica.
Però anche Masiero non è senza peccato… Bisognerà occuparsi anche di lui. Qualcuno ci riesce o siete solo capaci di sghignazzare?
@oca sapiens
Nessuna rabbia, faccio il mio mestiere di debunker chimico. Colgo tutte le occasioni che si presentano e butto giù un post o alimento un confronto commentando. Alla fine credo che ne esca qualcosa di utile. Per esempio credo che Gabrichan abbia ricavato da me qualche informazione utile su cui riflettere. Se non ci sono riuscito è solo colpa mia. Anche FermiGas è passato da CRC alle Tabelle JANAF, più complete. Mi fa piacere perché è valso la pena corrispondere con lui. Vedere che Giancarlo le ha scambiate con un’altra banca dati, mi dà la certezza di avere dato un buon contributo alla conoscenza della chimica. Se poi erano note a tutti non posso che compiacermi.
Franchini, Le sue lezioni sono sempre ben gradite, ma credo che quello che Le venga contestato si un errato punto di vista, credo che nel pensare comune ci sia una certa graduatoria tra le scienze si parte da:
Matematica, Fisica teorica, fisica, poi vengono la chimica e le varie applicazioni come l’ingegneria, la biologia e tutte le scienze minori.
Credo che faccia specie a tanti vedere un chimico attaccare un fisico su argomenti teorici basando le sue contestazioni su tabelle di dati sperimentali, quando in teoria un fisico dovrebbe essere in grado di ricavare gli stessi risultati facendo modelli teorici ed al limite verificarne l’esattezza basandosi sui dati sperimentali.
Che dopo il problema risulti troppo complesso per poterne fare una modellizzazione corretta e risulti più facile ricavare i dati da tabelle sperimentali quello è un altro discorso.
Credo che il limite sia oggettivo, quando ad entrare in gioco però sono un numero considerevole di variabili, no anzi le variabili sono poche ma è il numero di elementi che è molto alto creare dei modelli teorici è particolarmente difficile.
Ad esempio guardavo oggi un bel documentario di astronomia dove venivano mostrate delle belle simulazioni di collisioni tra galassie, davvero spettacolare ed interessante, ma non credo che di queste si possano creare dei modelli, si usano metodi informatici, si crea un bell’array di oggetti con le caratteristiche di una stella, posizione XYZ, massa, velocità, direzione e si cicla il tutto, stella per stella tenendo presente l’influenza che le altre hanno su quella sotto calcolo.
Credo che si possa fare anche con i gas e l’interazione tra superfici tenendo conto anche delle cariche elettriche degli elettroni.
Se non ricordo male la spettrometria è una soluzione molto comoda perché modelli teorici delle traiettorie degli elettroni se si supera un certo numero diventa davvero difficile da scrivere infatti si ricorre alla statistica e alla quantistica.
@gabrichan
A me fa invece specie che una disciplina che si chiama termodinamica chimica sia trattata da fisici, le cui conoscenze sono da autodidatta, dato che la termodinamica chimica non è materia di studio nei loro corsi di laurea. Sarebbe come se un chimico volesse occuparsi di particelle elementari.
Se Lei guarda le intestazioni delle colonne 2 ÷ 6 dei dati JANAF, si accorge che sono grandezze sperimentali importanti quanto il numero di Avogadro e la carica dell’elettrone. Senza quei dati non si può letteralmente fare chimica. Come per la carica dell’elettrone e del numero di Avogadro, non si cessa di aggiungere un decimale, ma si tratta solo di raffinatezze che non si ripercuotono sull’attività di laboratorio.
Circa la gerarchie che Lei fa delle varie discipline, io conserverei la posizione della Matematica, da cui ogni altra disciplina non può prescindere. La Fisica ha preceduto di secoli le altre scienze applicate, quindi merita particolare considerazione, ma dubito che nella pratica quotidiana si possa affidare un problema di chimica a un fisico teorico. Nelle vita le ore di applicazione sono finite e alla fine ognuno sa quello che è riuscito a imparare studiando e lavorando. Alla fine della vita un chimico è sempre più chimico, un fisico sempre più fisico.
Anche un matematico si troverebbe a disagio in biologia o in chimica.
Morale: ognuno faccia il suo mestiere, compresa oca sapiens sapiens, che pensa di poter procedere a colpi di intuito. Anche lei, come tutti noi, deve affrontare i limiti della sua istruzione di base.
I latini dicevano: sutor, ne ultra crepidam.
Non esiste nessuno strumento di previsione del tempo meteorologico più accurato e preciso della situazione meteo in tempo reale… trovo assurdi tutti questi commenti da 2 post a questa parte…….
Sandro la meteorologia non è una scienza esatta, però è in grado di dirti come sarà il tempo al 99,9% tra un minuto, la precisione scenda quasi a 0 se le vuoi tra un mese
Il modello matematico usato è ricorsivo, ovvero i risultati ottenuti vengono reimpostati come dati in ingresso all’equazione, è facilmente intuibile che se c’è un minimo errore di misura nei dati iniziali questo si propagherà ed aumentano a dismisura sfalsando i risultati finali, é il famoso “battito di farfalla in Australia che si trasforma nel tornado in America”
Franchini, credo sia questo il problema a Lei i fisici stanno proprio sulle scatole… 🙂
No seriamente provi a chiedere un po in giro, chieda la classifica alle varie persone che conosce vedrà che avrà delle sorprese.
@gabrichan
La Fisica mi piace; ho in casa una intera biblioteca di testi di Fisica. In questo momento sto leggendo come libro da spiaggia “Antimatter” di Frank Close, caricato su TrekStor.
I fisici mi stanno sulle scatole quando si occupano di chimica e di termodinamica chimica. Ma credo che capiti a tutti i chimici che conosco. I fisici non sanno stare al loro posto neanche se gli inchiodi i piedi.
Il problema è che in troppi conoscono la Fisica e questo dà a tutti molta disinvoltura, troppa. La Fisica è solo un pezzo delle conoscenze che servono per fare scienza.
@Claudio Della Volpe
Questo s’era capito da tempo.
A me non piacciono quelli che dicono che non gli piacciono quelli che lavorano per i militari.
Le dò un altro dispiacere: JANAF è acronimo di Joint Army Navy Air Force. Non solo, la commessa fu affidata alla Dow Chemical, che Lei certamente conosce. Dura eh?
@oca sapiens (e suoi tifosi)
Citazione:
All’ingenuo stupore di ferrari gabriele, che chiede il perché dell’affermazione sulle Dolomiti, Giorgio ‘Wegener’ Masiero risponde da par suo:
Tra qualche altro milione di anni, le Dolomiti saranno completamente franate…
Così tutte le montagne della Terra sono destinate a sparire.
E’ la seconda legge della termodinamica.
Commento di oca sapiens sapiens:
Un capolavoro!
Oca, ora la citazione è completa.
Mio commento:
Masiero ha perfettamente ragione.
La situazione mi sembra perfettamente chiara; Oca è convinta che la seconda legge della termodinamica non abbia niente che fare con la scomparsa di ogni forma di gradiente che il secondo principio comporta.
Per non lasciare dubbi, Oca sapiens sapiens ribadisce:
E Masiero giustamente ride sotto i baffi, compiaciuto di avere avversari come Oca. Oca sapiens sapiens è il punching ball di Masiero; sembra pagata apposta.
Oca, non hai amici che ti vogliano bene?
Salve Franchini
Però l’applicazione del 2pt alla morte della terra mi pare abbastanza facile; piuttosto, da ignorante, mi chiedevo se la termodinamica chimica spiega anche perchè la formazione della terra a partire da polveri non viola il 2pt.
grazie delle sue eventuali considerazioni.
g
@giorjen
Questione intelligente. Rispondo come mi viene in mente, lasciandola aperta ad altri interventi.
Se l’agglomerazione delle polveri a formare un pianeta avviene con diminuzione di energia libera, la trasformazione è compatibile con la termodinamica.
@FermiGas
Esiste la costante dei gas R.

Che cosa rappresenta R1 in questa equazione di Neutrino? Neutrino non ce l’ha mai spiegato. Lei lo ha capito? Si tratta di una costante che non è costante ma diventa “costante specifica dei gas”?
Franchini, intervengo qui di passaggio perché lei continua a commentare ciò che non ha letto con attenzione. Le parole di Masiero sono state riportate dal sottoscritto (Ivodivo) e commentate dal sottoscritto (sempre Ivodivo). Il sibillino titolo “L’oca riceve e volentieri pubblica” ha certamente tratto in inganno lei ed i lettori più attenti. 🙂
Si riferisca a me, se mi cita, come io faccio con chi cito (avrei potuto scrivere Pennetta, ma poi Masiero si sarebbe offeso…).
E per l’ennesima volta le ripeto che Masiero cita il s.p.t. per dimostrare la non-eternità della Terra. E che le Dolomiti mai e poi mai potranno soccombere sotto l’azione dell’entropia, essendo destinate a svanire per ben altri motivi….
Il giullare Ivodivo
@Ivodivo
Benvenuto in questo blog.
Rispondo velocemente perché al mattino c’è da fare.
Le cito un passaggio di Paul Davies che La può interesare.
Franchini, grazie per il benvenuto.
Anch’io ho da fare e mi affido a una citazione:
The cyclic universe theory is a model of cosmic evolution according to which the universe undergoes endless cycles of expansion and cooling, each beginning with a “big bang” and ending in a “big crunch”.
Fonte: http://www.accessscience.com/content/cyclic-universe-theory/YB090037
Autore: Steinhardt, Paul J. Princeton Center for Theoretical Science and Department of Physics, Princeton University, Princeton, New Jersey.
Uno spunto di riflessione in più.
@Ivodivo
Ottimo spunto per le riflessioni della sera.
@Claudio Della Volpe
Esagerato.


Callen dedica alla termodinamica irreversibile 17 pagine su 511;
molto spazio è riservato agli esempi.
Scrive anche:
Pingback: Temperatura e termodinamica | OggiScienza
@Claudio Della Volpe
Ora capisco.
Le posso chiedere se Lei è uno studioso di omeopatia? I tre personaggi che ha nominato avevano in comune la passione per l’omeopatia. Anche Lei?
Capisco anche perché Oca sapiens sapiens è tanto tollerante nei Suoi confronti. I conti tornano perfettamente, se Lei risponde che è omeopata.
Lo chiedo anche a Cimpy, che di solito è bene informato.
@Cimpy
Le piace l’ultima versione di Oca sapiens sapiens?
Non si dà pace, vuole a tutti costi convincere i suoi giullari e tifosi che lei conosce la termodinamica meglio di Masiero. La termodinamica del ferro da stiro. Mai vista tanta passione, fra un po’ schianta.
@Neutrino
D’accordo.
Meraviglia che la gente abbia considerato il “qualche milione di anni” di Masiero una previsione temporale vincolante come quella dell’aeronautica militare.
Masiero ha semplicemente messo in evidenza che le Dolomiti saranno spianate in un ambito temporale che la termodinamica sovranamente ignora. Ma saranno spianate in base all’esigenza termodinamica di annullare tutti i gradienti.
Fallo capire a quella francese di oca sapiens.
Secondo me Masiero le deve essere molto antipatico. Tu dici che a me un fisico ha soffiato la fidanzata. Masiero deve aver preferito l’amica di oca.
Non c’è nessuna amica (!!, ma Masiero è un creaziionista e i suoi discorsi anche quando partissero bene poi arrivano male per gli inevitabili scivoloni nella fede (che andrebbe tenuta separata dalla scienza.)
Neutrino, Franchini ha detto “d’accordo”…
@Cimpy
Come debunker mi interessa solo che Oca sapiens sapiens si sia permessa di contraddire Masiero sul destino delle Dolomiti.
Il resto, se siamo interessati, lo possiamo discutere in un altro thread.
Ma scusi, Masiero no e Claudio Della volpe sì, anche se è ammiratore di Elia, Preparata, Del Giudice e forse omeopata egli stesso?
Un giorno o l’altro sapremo chi è Claudio Della Volpe e capiremo tutto.
E’ sicuro che Masiero ha preferito l’amica della sfortunata oca.
Dottore., con CDV sono disposto a litigare su quanto a lungo si possa far volare continuativamente e per che media di giorni all’anno un aquilone (perché un po’ di esperienza coi venti ce l’ho persino io), ma non altro – ha già scritto che di quei tre ammirava l’intelligenza ma che si erano sbagliati.
Non posso parlare per lui, lo dirà di persona se vuole ma sono confidente che non creda nella memoria dell’acqua o nella fusione fredda alla F&P o in costantana o alla Rossi o alla Carpinteri (ecc).
Ora me ne resto in disparte, la invito solo a riconciliarsi con Neutrino, Oca Sapiens, CDV e (se mai sia possibile) con Hornbeck; se necessario anche con Giancarlo, FermiGas, Gvdr; per altri tre o quattro scavezzacolli di taglia piccola (forse) non c’è problema: se si ritrova una sintonia, noi si fa festa
Un momento, dottore, lei sta mischiando le carte in tavola su cosa Neutrino abbia detto davvero
E continua a mancare di rispetto ad Oca Sapiens.
Bene, mi eclisso.
@Cimpy
Si tratta di pari opportunità. Oca sapiens sapiens può essere trattata male come Psicopompo moderno o Celani.
@Cimpy
Grazie per la segnalazione, c’è materia bastante per il post “Neutrino2”.
Bisognerebbe leggere tutto anche da Oca.
Il problema è che Neutrino ha traslocato definitivamente, complicando la vita agli appassionati di montagne e termodinamica.
Lei faccia da tramite se mi sfugge qualche intervento termo. Grazie.
Appena piove scrivo un altro post dedicato a Neutrino e alla sua Termodinamica.
@Mahler
Lei conosce un trattato di termodinamica chimica scritto da un fisico? Se ne conosce uno sarei felice di procurarmelo. Per un fisico la termodinamica si ferma alle macchine e al loro rendimento.
Dico sul serio, non escludo che un fisico abbia scritto un buon trattato di termodinamica chimica.
“Nemico” è un termine fuori luogo. Si tratta di antagonismo intellettuale una cosa del tutto innocente.
CDV è un Chimico che insegna Termodinamica; nel discorso del confronto sta dalla stessa parte (ta gli altri) di Oca Sapiens, Neutrino, Giancarlo, Hornbeck. Se io fossi al suo posto, Franchini, mi chiederei se per caso non ci fosse qualcosa che mi è sfuggito – magari è solo un problema legato a certe premesse o ad un ambito particolare.
Non sottovalutrerei il fatto che Masiero avesse un obiettivo ben preciso nel fare i discrosi che ha fatto. Nessuno dice che tutto quello che scrive Masiero non vada bene, ma che da certe premesse arriva a conclusioni quantomeno discutibili, anche solo per commistione spirituale – un po’ come Carpinteri, per intenderci, anche senza terremoti e gamma, ma con Angeli canterini e Galassie create per l’Uomo, centro dell’Universo per bontà divina…
@Cimpy
Se CDV vuole intervenire può farlo liberamente. Per adesso mi sembra si sia solo sfogato. Ha anche detto una bugia, affermando che la termodinamica non all’equilibrio occupa tre quarti del Callen, mentre si tratta di un capitoletto di 17 pagine, quasi tutto dedicato ad applicazioni. Chi sia Onsager lo sanno tutti i chimici e tutti conoscono la sua equazione del 1931. Sarà stato bravissimo, ma oggi i chimici di tutto il mondo si affidano alle Thermochemical Tables JANAF, cioè alla termodinamica chimica classica, che comprende anche la termodinamica statistica.
Comunque qua si ha l’abitudine di ragionare sui post e sui commenti, senza guardare nome e cognome della gente. Ovvio che la risposta a un quesito di fisica debba venire da un fisico, evitando strani incroci di competenze.
Gabrichan è informatico, ma ha posto a Neutrino una domanda di termodinamica molto pertinente.
@ Camillo Franchini
E’ curioso come uno dei primi sfondoni nell’applicazione della meccanica statistica (così evitiamo il problema del tempo: in MeccStat è presente!) riguardi proprio un problema di geologia: l’età della terra. Come è noto, Lord Kelvin calcolò un’età massima di circa 3X10^5 anni.
Molti sono convinti che l’errore di Lord Kelvin sia da imputarsi al fatto che avesse trascurato il calore generato dai decadimenti radioattivi. In verità il problema stava solo nelle assunzioni iniziali implicite, problema di cui si accorse il suo giovane assistente e che avrebbe potuto portare a stime più realistiche dell’età della terra…
saluti
@Valerio Peralta
In termodinamica statistica il tempo è assente; perlomeno non credo di avere mai incontrato una relazione in cui il tempo è presente. Mi aiuti a ricordare.
Saluti
@Camillo Franchini
devo ammettere che non avevo mai incontrato la “termodinamica statistica” come disciplina a se stante. Ho trovato in rete questo documento:
Fai clic per accedere a termodinamica%2520statistica-21giu11_7.pdf
in cui viene citata.
saluti
@Valerio Peralta
Grazie per la segnalazione.
Avrà notato che da nessuna parte nel lavoro del Prof. Gigli figura la grandezza tempo.
@Valerio Peralta
La termodinamica è indipendente dal tempo perché fa uso di funzioni differenziale esatto. Una funzione termodinamica è definita se si conoscono stato iniziale e stato finale del sistema. I passaggi intermedi sono ininfluenti; il tempo impiegato dalla trasformazione è indifferente.
L’entalpia della reazione di combustione del butano rimane costante sia se la reazione è condotta in modo esplosivo, sia se viene fatta avvenire lentamente in un stufa catalitica.
L’uso della funzioni di stato affranca la termodinamica dal tempo.
@Gabrichan
Domanda molto ben posta che appoggio con entusiasmo.
Vediamo che cosa risponde Neutrino.
Neutrino molto cortesemente ha risposto, riporto qui quanto detto per semplicità
http://ocasapiens-dweb.blogautore.repubblica.it/2014/08/18/il-cattivo-maestro/comment-page-2/#comment-599645
@GabriChan
Che un sistema termodinamico tenda allo stato di massima entropia e’ vero solo se si aspetta un tempo infinito.
Tale affermazione ci da informazioni quantitative solo sullo stato finale del sistema e non della sua storia.
Se volessimo studiare il come, il quando e con che rate vengono eliminati determinati gradienti avere informazioni sullo stato finale non ci aiuta.
L’affermazione in se non e’ sbagliata, ma e’ completamente priva di predittivita’ quindi più’ metafisica che fisica.
(affermare che tutti gli uomini sono mortali non serve a determinare la data della mia, spero lontana, dipartita)
Inoltre nel caso specifico, avrei difficoltà a trattare una montagna in senso termodinamico. Una montagna e’ disomogenea, i gradi di libertà’ microscopici sono fortemente correlati su scale spaziali macroscopiche etc etc.
Cioe’ banalmente una montagna non e’ un sistema termodinamico. Se voglio studiare la sua evoluzione devo studiare un sistema dinamico semplice, anche con simulazioni numeriche.
Ultima considerazione storica: prima di Boltzmann la termodinamica fisica era una teoria puramente fenomenologica, con forti approssimazioni sulle sue assunzioni di base. E’ il lavoro di Boltzmann e di altri che ne fanno una delle migliori teoriche effettive che abbiamo collegando la visione macroscopica della termodinamica con la dinamica dei costituenti microscopici..
Boltzmann connette la dinamica con la termo-dinamica (statica).
L’intuizione e’ stata potente e feconda che nello studio di molti sistemi dinamici (vedi modello di hopfield per le reti neuronali) e’ conveniente introdurre una temperatura fittizia per studiare il modello termodinamico equivalente (o meglio la funzione di partizione ) e tornare al limite per temperatura fittizia che tende a 0.
Un altro metodo e’ usato nello studio della CromoDinamica. Si definisce la teoria su reticolo quadridimensionale, si esegue una rotazione di Wick (t –> it). Si ottiene un sistema termodinamico, si studia tale sistema numericamente e si torna al problema origine semplicemente mandando it –> t.
e anche la risposta di Mhaler mi sembra molto pertinente:
@tutti-i-tifosi-del-tempo-nella-termodinamica
@Camillo
È la prima volta che intervengo in questo blog. La premessa necessaria è che ritengo opportuno censurare categoricamente l’atteggiamento di Camillo in questa discussione:
1) Nel metodo. La personalizzazione di uno scontro in cui il nemico è stato identificato con la figura di Neutrino prima, con l’INFN poi e infine con tutti i fisici intesi come categoria è completamente fuori luogo.
2) Nel merito. Imparare ad adoperare il «pensiero laterale» dimostrato da Neutrino e FermiGas è molto più utile agli studenti che non l’acquisizione di una conoscenza enciclopedico-mnemonica. Mi auguro che seguano la scia di Neutrino e non quella di Camillo.
Fatta questa breve premessa, per quanto riguarda tempo e termodinamica tengo a sottolineare un punto che sembra sfuggire a tutti. Escludere il tempo non vuol dire fare una termodinamica parziale o “implicita”, come qualcuno ha affermato qualche commento fa, dove il tempo è quasi il convitato di pietra mai nominato ma alluso, il Godot della della termodinamica: anche qui si tratta di una questione che chiama fortemente in causa il metodo. Definire lo stato di equilibrio di un sistema a prescindere dal tempo significa che la frase «Lo stato di equilibrio del sale versato nell’acqua è la soluzione» è indipendente dal tempo che impiegherà a raggiungerlo: quell’equilibrio è una proprietà del presente di quel sistema, anche se il sale è stato appena versato e non ha ancora raggiunto l’equilibrio, anche se prendo a cannonate il bicchiere prima che l’equilibrio venga raggiunto. Se introduco il tempo, in qualsiasi forma, escudo questa proprietà dalla descrizione del sistema.
Perché è importante definire l’equilibrio come una proprietà presente di un sistema? Perché la sua capacità di compiere lavoro ai fini del raggiungimento dell’equilibrio ha un peso piuttosto importante, mentre il tempo che impiegherà a compierlo è irrilevante.
È chiaro che, ai fini pratici, considerare o meno il tempo dipende da qual è la mia disciplina e da cosa intendo fare con quell’acqua salata (se intendo solamente «pesare» il sistema, ripeto, il tempo è fuori luogo; se intendo fare cocktails al bar il tempo ha la sua importanza).
Tenere fuori con rigore il tempo da una parte della termodinamica (quella classica) è un’importante questione di eleganza e di metodo. Per tutto il resto c’è il non equilibrio, of course.
Saluti.
Sostanzialmente entrambi dicono che l’affermazione di per se è corretta e questo mi sembra un buon punto di arrivo, che dopo il sapere che le dolomiti si appiattiranno in effetti non ha poi cosi tanta importanza come informazione visto che non ci sarà più nessuno a scalarle.
Ps. personalmente non mi piacciono gli attacchi personali, quindi anche a me il comportamento di Franchini nei confronto di Neutrino non mi è affatto piaciuto, spero che la discussioni torni su un confronto puramente scientifico li ci si può scannare quanto si vuole.
Mamma mia che postacci che è il blog dell’Oca sono stato attaccato da facinorosi senza aver dato il ben che minimo appiglio solo per il gusto di rompere le balle alla gente…..
@gabrichan
Grazie per il materiale che mi ha procurato. E’ adatto per procedere a “Neutrino2”. Devo solo aspettare che passino alcuni impegni estivi.
Niente di personale contro Neutrino; per me rappresenta in modo paradigmatico il fisico che si occupa di termodinamica chimica. Neutrino offre lo spunto per chiarire alcuni concetti di termodinamica chimica.
Credo che Neutrino sia l’ultimo a irritarsi; nemmeno io mi sono irritato per i suoi atteggiamenti nei miei confronti.
@Claudio Della Volpe
Ai miei tempi Atkins non esisteva e ho studiato su altri trattati, ma mi sembra che Atkins sia una buon testo di introduzione alla Chimica Fisica.
A chi fa ricerca chimica servono le Tabelle JANAF, i diagrammi di Pourbaix e tutte le altre banche dati. I trattati si danno per scontati.
Elia è un tipo curioso, ci siamo scritti anni fa, ai tempi in cui i blog non erano comuni. Ha idee molto strane sull’acqua e io ho lasciato perdere. Mi sembra appartenga alla categoria dei “creativi” à la Preparata. Con tutto il rispetto, non intendo fare polemica.
Sbaglio o Lei crede che al di fuori del Suo centro di ricerca non si faccia niente?
@Tutti
Ho approfittato di un temporale per scrivere “Neutrino2”. Il commento di Neutrino consente un interessante confronto tra termodinamica chimica e termodinamica fisica. Spero che nel post troverete spunti per osservazioni stimolanti. Immagino che vengano soprattutto da Gabrichan, attualmente il blogger più attento e più capace di osservazioni costruttive in questo campo.
Se qualcuno continua a essere ancora interessato a questi argomenti, sarebbe opportuno non disperdere le osservazioni in troppi blog. Credo che pochi abbiano voglia di seguire interventi dispersi qua e là in rete. Per esempio a me era sfuggito quello di Neutrino oggetto di questo post. Il primo a propormelo è stato Cimpy che ringrazio.
Ma fate come preferite, io cerco di essere all’altezza, magari con il vostro aiuto.
Pingback: Prima i bambini – Ocasapiens - Blog - Repubblica.it