Neutrino ha proposto un articolo per dimostrare che “nessun dato sperimentale è necessario per la derivazione di alpha”, grado di dissociazione dell’idrogeno molecolare. “Potenza della termodinamica statistica !” commenta entusiasta.
Sarebbe davvero una bella prova di potenza. Vale la pena di controllare per godere insieme.
L’articolo ha un titolo sorprendente, che ci porta sulle stelle.
Christian Frønsdal
Heat and Gravitation. III. Mixtures
Fai clic per accedere a 1001.2579v2.pdf
Fin dall’inizio si è posti di fronte a una importante limitazione: “this paper applies the action principle to a study of mixtures of ideal gases.” Gas ideali? Si trovano solo nelle elaborazioni dei teorici, che sono costretti a semplificare. Il modello del gas ideale è una scatola di palline dotate di un solo grado di libertà, che non interagiscono in alcun modo, privi di moti rotazionali o vibrazionali. Il solo gas reale che risponde a queste caratteristiche è l’idrogeno atomico.
Proseguendo nella lettura si scopre che l’articolo è piuttosto ambizioso:
“It leads to a convenient theoretical framework in which many dynamical problems can be studied,and in which the incorporation of General Relativity is straightforward.”
Ci compiaciamo che nel lavoro l’incorporazione delle Relatività General sia considerata straightforward.
Dopo avere saltato molte pagine di calcoli, si arriva a pag. 16 dove viene introdotto il concetto di “densità totale” ρ = ρ1 + ρ2 di un miscuglio di idrogeno molecolare e atomico. Nella realtà esistono la densità iniziale ρ° dell’idrogeno indissociato e la densità ρ attuale del miscuglio di molecole e di atomi di idrogeno. Il concetto di densità totale è sconosciuto. A dissociazione totale ρ° = 2 ρ. La densità del miscuglio non può essere data dalla somma di due densità. Eventualmente dovrebbe essere una sorta di somma pesata.
Ma l’equivoco continua con l’introduzione di r = ρ2 / ρ che, secondo Neutrino, dovrebbe corrispondere al grado di dissociazione dell’idrogeno. Non è così, perché il grado di dissociazione dell’idrogeno α in funzione della densità gassosa è rappresentato dalla relazione α = (ρ° – ρ)/ ρ.
Basta fare due calcoli per rendersi conto che α = 1 per ρ = ρ°/2 e α = 0 per ρ = ρ°. Questi valori di α estremi non si riscontrano nella formula di Frønsdal r = ρ2/ρ.
Da osservare che anche se l’articolo fosse formalmente corretto, i dati di α forniti non possiedono l’affidabilità di quelli ricavabili dalle Tabelle JANAF, essendo questi basati su dati sperimentali certamente suscettibili di miglioramenti fini, ma poco significativi da un punto di vista pratico. Mentre è possibile calcolare l’errore di un dato sperimentale, non è possibile farlo per dati ricavati da ipotesi teoriche.
Insomma si ha la sensazione di trovarsi di fronte a un articolo molto ambizioso che sembra contenere assunzioni discutibili, fortemente stressato da Neutrino alla ricerca di un modo di calcolare α non richiedente l’uso di banche dati sperimentali.
Mi pare che Neutrino sia incorso in un errore metodologico, affidando tutto il peso della sua dimostrazione a un articolo o due. Anche se avesse trovato una soluzione alla dissociazione termica dell’idrogeno, la legge trovata non sarebbe di validità generale perché non tiene conto della variazione con la temperatura del calore specifico delle specie in equilibrio. Per esempio non è applicabile alla dissociazione termica dell’ipoazotide.
Certamente lo sviluppo della discussione porterà a ulteriori chiarimenti, a considerare aspetti che ho trascurato o male interpretato. L’articolo di Frønsdal è molto complesso e gli errori (anche miei) sono sempre incombenti.
Il tema è di enorme interesse, perché viene proposto un approccio fisico a problemi di termodinamica chimica. Proviamo a lavorare insieme occupandoci dell’ipoazotide.

@Franchini
Se non avesse saltato le pagine di calcoli, avrebbe visto che nell’articolo rho_i = M_i/V ed \hat rho_i = M_i/V_i (mi scuso per la notazione pseudo-latex, non so come inserire simboli e lettere greche nel commento).
seguo
Mi accodo per i commenti
@ocasapiens
Ai chimici dell’ORIM non serve niente essere competenti; a loro interessa solo che la comica Fuf continui. Essere alla dipendenza organizzativa di Celani, con ORIM che riceve commesse dall’INFN, è una bella botta di fortuna. Perché dovrebbero sputare nel piatto dove mangiano? La disgrazia di Celani è anche la loro; ora non potranno più ridere sotto i baffi sulla dabbenaggine dei Fuf nazionali, saranno entrati in crisi. Chissà quanto palladio hanno venduto, avendo clienti ricchi come INFN ed ENEA. Sembra che i primi mesi dopo marzo 1989 il prezzo del palladio abbia subito un’impennata, tanti erano i gonzi ad acquistarlo. I clienti chimici sono sempre stati una frazione insignificante rispetto ai fisici. Basta leggere le pubblicazioni ff per rendersene conto. La ff è stata un’iniziativa promossa da fisici.
@oca sapiens
Su argomenti di termodinamica chimica mi aspettavo un comportamento di questo tipo; mi spiazzerebbe invece una critica proveniente da un chimico.
@Andrea
Non poteva essere espresso meglio. Se anche in la cinetica si disponesse di tabelle, la faccenda della bombolina avrebbe avuto una risposta a priori. Invece si è dovuto attendere il lavoro di Massa per capire che la pressione di idrogeno in un catodo cavo di palladio diventa costante a 80 atmosfere. Era come giocare a gratta e vinci, qualunque numero poteva essere corretto (il ragionamento è rivolto agli amici del blog).
Non è che la pressione si è fermata a 80 Bar, Mario per motivi di sicurezza non ha proseguito con l’esperimento, ma volendo la pressione poteva salire ancora di molto.
@gabrichan
La pressione nella bombolina non può crescere indefinitamente; si arriva a un equilibrio in cui la quantità di idrogeno che entra è uguale a quella che esce. Effetto camera d’aria di bicicletta bucata.
Era già stato detto.
Si ma il limite era ben più alto di 80Bar, quel valore era quello a cui si era fermato Mario con la configurazione del suo esperimento.
@Cimpy
Io credo che Andrea intenda fare riferimento al concetto di rendimento di corrente di un processo elettrolitico; un catalizzatore può abbassare le inerzie di qualsiasi tipo e aumentare il rendimento di corrente. Se non è così speriamo che Andrea ci spieghi meglio.
Non si capisce perché il gruppo sia diventato oggetto dell’attenzione di Oca. Devo rileggere il passo per capire di più.
@Franchini
Lei vorrei chiedere qualcosa sull’effetto NEMCA, perchè non ho capito bene quale sia il meccanismo in grado di moltiplicare in maniera così considerevole le capacità catalitiche di certi materiali:
http://en.wikipedia.org/wiki/Non-faradaic_electrochemical_modification_of_catalytic_activity
E’ possibile secondo lei usare anche l’idrogeno in questo tipo di sistemi ?
@Sacha
Nemmeno io lo so, bisognerebbe leggere un articolo. Le riviste su cui l’argomento viene trattato sono importanti, quindi varrebbe la pena saperne di più. E’ un argomento molto interessante. Attualmente i brevetti chimici più importanti riguardano i catalizzatori. Natta diventò Nobel per un singolo catalizzatore stereospecifico. Erano gli anni della petrolchimica.
Mi piacerebbe leggere un articolo su NEMCA.
@ocasapiens
dai fisici perché non sanno niente di termodinamica chimica e di tabelle NIST-JANAF.
Rimasta turbata eh? Scommetto che hai sentito parlare di quelle tabelle solo da me. Volevo farti una sorpresa.
Pensa che all’esistenza dell’hydrino crede anche un fisico che insegna all’Accademia di Livorno, credo anche Mastromatteo. E’ possibile che Dufour abbia presentato l’hydrino a qualche ICCF, basta aver voglia di cercare.
@Franchini
Mi piacerebbe leggere un articolo su NEMCA.
https://www.researchgate.net/profile/Spyridon_Ladas/publication/234013611_ELECTROCHEMICAL_PROMOTION_IN_CATALYSIS_-_NON-FARADAIC_ELECTROCHEMICAL_MODIFICATION_OF_CATALYTIC_ACTIVITY/links/09e4150c45c474663b000000
@Sacha
Grazie mille, l’argomento è molto interessante.
@Franchini
https://www.researchgate.net/profile/I_Yentekakis/publication/222474759_In_Situ_controlled_promotion_of_catalyst_surfaces_via_NEMCA_The_effect_of_Na_on_the_Pt-catalyzed_CO_oxidation/links/0912f50af526e872db000000
L’ha ribloggato su fusionefredda.
@gabrichan
Io sono al corrente solo dell’esperimenti di Massa e Suo. Che sappia, qualcuno l’ha stabilito per un certo spessore della parete della bombolina? A me non risulta; mi risulta al contrario che Arata non poneva affatto limiti, come avviene nella compressione a cella chiusa.
Non mi ricordo che risultati ha ottenuto con la Sua bombolina.
Per tornare un attimo sull’argomento La invito al leggere questo documento:
http://www.nrcresearchpress.com/doi/pdfplus/10.1139/v59-030
é abbastanza interessante, viene considerata la migrazione dell’H+ nel Pd che è legata alla densità di corrente elettrica fatta passare nel catodo, cosa che non ha mai considerato nei ragionamenti Lei che ha fatto sulla bombolina.
Anche la parte sul Ni è interessante, stando a quello che dicono il Ni non assorbe H+ quindi tutte le reazioni avvengono in superficie.
Per la mia bombolina come avevo detto ho avuto dei seri problemi di tenuta e quindi le pressioni raggiunte non sono state un gran che.
@Neutrino
Dissociazione del tetrossido di azoto
Vale la pena di considerare la dissociazione di un gas tipicamente reale come il tetrossido di azoto per dimostrare l’universalità di applicazione delle Tabelle NIST-JANAF e l’impossibilità di ottenere gli stessi risultati per via esclusivamente teorica. I due gas sono talmente lontano dall’idealità che si possono considerare vapori. Le Tabelle JANAF tengono conto di questo e forniscono la risposta corretta, la sola “garantita” perché basata su grandezze misurate.
Inoltre la dissociazione del tetrossido di azoto è significativa perché imita quella dell’idrogeno.
N2O4 ↔ 2 NO2
Si considera la dissociazione alla temperatura di 350°K, alla quale α ha un valore lontano da 0 e 1.
JANAF fornisce i seguenti dati:
ΔG° N2O4 = 113.251 kJ·mol-1
ΔG° NO2 = 54.445 kJ·mol-1
R = 8,3144 J· gradi-1·moli-1
lnKp = – ΔG°/RT
Kp = 4,48
Per una pressione di 0.1 MPa si ottiene:

= 0,73
Controllo (meglio essere prudenti, potrei avere sbagliato tutto, per questo mi affido a FermiGas dopo avere scritto numeri):
“nella dissociazione del tetrossido di azoto in ipoazotide (N2O4 = 2NO2), alla pressione di 261,37 mm di Hg e alla temperatura di 49°, 7 °C, il grado di dissociazione è 0,630”.
Enciclopedia Treccani.
@Neutrino
I molecular parameters sono determinati sperimentalmente per mezzo delle varie spettrometrie, come usa comunemente con le sostanze gassose. Molto usato è l’infrarosso.
Dice uno dei miei testi:
Many Free-energy changes, particularly for gaseous reactions, may be calculated from theoretical analyses of vibrational and rotational energies of molecules.
Si tratta insomma di dati sperimentali elaborati con theoretical analyses.
In ogni caso so con certezza che non riuscirai mai a trovare con mezzi personali il valore di α per la dissociazione del tetrossido di azoto a 350°K. Stai consultando freneticamente la rete, ma riuscirai al massimo ad affidarti al lavoro di altri.
A me è bastata mezza paginetta di calcoli per ottenere un risultato perfettibile solo se sono perfettibili i dati sperimentali.
Se non fossi così orgoglioso, scriveresti agli studenti di fisica che affermare “nessun dato sperimentale è necessario per la derivazione di alpha” è un grave errore concettuale, una pessima applicazione del metodo scientifico, la creazione di illusioni.
Ma vedo che sei molto orgoglioso e continuerai a cercare soccorso in rete. Bel metodo scientifico, sembri uno studente che deve preparare una tesina.
@Neutrino
Per uno studente di fisica il problema è molto più serio. Per loro si tratta di sapere se è vero che
“nessun dato sperimentale è necessario per la derivazione di alpha”.
E’ un argomento di importanza enorme, che vale il mantenimento del confronto.
Chi faccia fisicamente la determinazione dei molecular parameters importa poco; la polemica tra chimici e fisici riguarda me, te e oca; non interessa gli studenti. Al massimo interessa Psicopompo, ma a lui interessa tutto, gli piace partecipare.
@Sacha
Attento, Oca non è abituata ai guastafeste; ha addestrato Psicopompo a fare il castigamatti. L’avevo avvertita che è un po’ prolisso e querulomane, ma a lei piacciono così.
@Franchini
Mi dispiace molto per ocasapiens, ma da sola non è assolutamente in grado di fare fronte ai FuF più scaltri. Spero se ne renda presto conto.
@Sacha
A pensarci, non mi rendo conto perché Neutrino abbia voluto contestare una classica curva di termodinamica chimica che avevamo trovato insieme FermiGas e io.
@Neutrino
Ti aiuto a ricordare. Tu hai scritto:
Io contesto in pieno quell’affermazione e mi sono messo nella condizioni di sfidarti.
Prova. Ora siamo solo agli inizi con la dissociazione del tetrossido d’azoto. Io ho già fornito la mia risposta.
Concedetemi un considerazione personale, è ovvio che più la struttura diventa complessa più è difficile a livello teorico fare i calcoli sul comportamento e caratteristiche di una molecola, finché si tratta di H2 si riesce abbastanza facilmente, quando la struttura diventa complessa le cose si complicano enormemente (qui Franchini è sleale nei confronti di Neutrino) e quindi ci si rivolge a valori sperimentali tabulati.
Continuo però a pensare che la posizione di Neutrino sia corrette, sia a livello formale che come docente, il cui dovere è insegnare ai propri allievi a ragionare sulle cose, a cercare la documentazione e estrapolare le informazioni necessarie per risolvere un problema.
Mi aspetto questo da un buon insegnante di fisica, a un chimico serve avere dati sperimentali immediati per poter progettare e lavorare sulle sintesi, a lui non serve il retroscena teorico, ad un fisico si, perché lavorerà sui gas di una super nova o sul comportamento dell’idrogeno a bassa temperatura in un condensato di Bose, deve avere in mano degli strumenti che vadano oltre a delle tabelle in un DB.
@gabrichan
Rimprovero a Neutrino di essere intervenuto a sproposito sui grafici di FermiGas e quello mio con osservazioni assolutamente fuorvianti come:
Si trattava dell’impiego dei dati sperimentali JANAF.
Neutrino sembra conoscere casi in cui la termodinamica chimica non è valida.
In quale altro contesto dovrebbe essere valida?
Infatti non sa usarle, poteva ammetterlo subito.
Chissà cosa vuol dire.
Alla fine delle sue considerazioni, Neutrino produce questo grafico:
Nessun commento, nemmeno quando gli ho chiesto che roba era e se i risultati proposti erano confrontabili con quelli sperimentali ricavati dalle Tabelle JANAF.
Lei scrive “finché si tratta di H2 si riesce abbastanza facilmente”, senza tener conto che Neutrino non è affatto riuscito a dimostrare che dati di dissociazione gassosa dell’idrogeno si possono ricavare per via puramente teorica.
Non sapevo che fosse insegnante di fisica; ho quindi ragione di preoccuparmi per i suoi studenti.
Ancora mi chiedo perché Neutrino ha sentito il bisogno di occuparsi del lavoro che FermiGas e io abbiamo fatto, in totale modestia, solo per rispondere a un dubbio di Maxwell1961, che non ci ha nemmeno ringraziato.
Speriamo che Neutrino non venga sentito sulle interrogazioni parlamentari.
@gabrichan
Scusi se rispondo a spicchi, ma di giorno uso ritagli di tempo.
Il problema è che tutti conoscono la fisica, quasi nessuno conosce la chimica, che quasi sempre si riduce a un derelitto esame del primo anno, una settantina di lezioni in tutta la vita universitaria. Immagini cosa resta.
A un chimico serve il retroscena teorico come a un fisico. Esiste una materia di studio che si chiama “Chimica teorica” ma pochi lo sanno, mentre tutti sanno che esiste la Fisica teorica.
Io, anche per motivi di età, ho scarse conoscenze di Chimica teorica e dubito che ci capirei qualcosa, appunto per motivi di età.
In questi giorni ci siamo occupati di chimica che avviene sulla Terra. Solo Neutrino ha fatto un’imprudente escursione sulle stelle, dove la chimica convenzionale non esiste. Le Tabelle JANAF sono tabelle che caratterizzano dal punto di vista termodinamico tutte le molecole che sono state studiate, sono quindi tabelle chimiche, universali perché valgono fino a 6000 °K, una temperatura che non si raggiunge in un laboratorio chimico.
No, ho solo voluto dimostrare l’universalità delle Tabelle JANAF. Con esse si risolvono problemi che non possono essere affrontati per altra via, come suggerisce incautamente Neutrino; direi tutti i problemi che la termodinamica chimica pone. In questo senso Neutrino è cattivo maestro, confonde gli studenti. Inoltre insegna che si può giocare con profitto fuori casa. Magari. Fisico sei e fisico resti. Chimico sei e chimico resti. Ci sono anche degli incroci fortunati, come quello realizzato da Gibbs, ma i suoi erano tempi in cui i confini tra le materie erano meno definiti. Comunque bisogna chiamarsi Gibbs. Non è il caso mio, di Neutrino o di Gabrichan.
Ne riparliamo.
Ok, guardiamo se ho capito i punti di vista, Il suo Franchini è: esistono le tabelle JANAF e se uno sa come consultarle ricava tutti i dati necessari a risolvere i vari problemi di termodinamica e di equilibrio di una certa reazione chimica.
Però negando che ci possa essere una via teorica più o meno complessa per arrivare allo stesso risultato.
(Io da informatico penso che ci possa essere una via numerica per risolvere la cosa 🙂 )
Neutrino invece sostiene che con la termodinamica statistica si possa comunque arrivare a definire una equazione che risolve la cosa senza dover consultare le tavole JANAF che sono un compendio di dati sperimentali.
In più si mette nella posizione di dire io “ammesso che insegni, ma da quello che ho capito lo fa” devo mettere i miei allievi in grado di risolvere i problemi, cercando la documentazione necessaria e ragionando sulle formule devono essere in grado di
risolvere il problema.
Comunque credo che ora il corso si chiami “corso di chimica fisica” es.:
http://oldwww.unibas.it/utenti/dalessio/bio.html
è interessante il libro consigliato:
Fai clic per accedere a Physical%20Chemistry%20for%20the%20Life%20Sciences%20%28%202008%20ISBN%209781429280570%20%29%20Peter%20Atkins%20Julio%20de%20Paula.pdf
Cap. 3.
@Neutrino
Ti stai nascondendo dietro una cortina fumogena di parole perché non sei capace di dimostrare che:
“nessun dato sperimentale è necessario per la derivazione di alpha”
Quindi per te l’applicazione degli strumenti della termodinamica chimica sarebbe patologia grave.
Ora è facile capire perché le ricerche Fuf sono durate 25 anni all’INFN; avete cercato di non aderire in modo acritico alla conoscenza scientifica acquisita in campo nucleare. Tout se tient, Celani non poteva essere caduto dal cielo. Ha trovato il brodo di coltura favorevole. La prosa di Celani è singolarmente simile alla tua, stesso andamento retorico.
@Sacha
Piacerebbe molto anche a Indopama. N. è un fisico ispirato, portato per la filosofia della scienza. Forse è proprio la materia che insegna.
Devo scrivere qui, altrimenti oca mi accusa di insultare Neutrino. E’ bene protetto, deve essere importante.
@Gabrichan
solita risposta parziale, dato che fra poco vado a pranzo.
No, il Corso di Chimica Fisica è un corso biennale che comincia dal 3° anno della laurea magistrale in Chimica.
Un testo misto è il Silvestroni (semplice e ottimo, da consigliare a tutti, anche ai chimici), che però può fare poco in 800 pp.
Altro testo misto è quello presentato da Giancarlo: Atkins-Jones, Principi di Chimica, Zanichelli.
Molti docenti cercano responsabilmente di concentrare i vari concetti di cui si compone la Chimica, ma con risultati modesti, dato che un corso universitario non va oltre 70-80 ore di lezione (se ricordo bene, mi corregga). Resta il possesso del testo, ma lo studente di fisica o ingegneria deve studiare altre materie, preparare altri esami. Il bel testo di Chimica resta nello scaffale, se non viene venduto per comprare gli altri. Risultato, la chimica è nota solo a chimici e biologi. Mi scuso se ho trascurato qualche facoltà moderna.
Lei, persona piena di buona volontà che stimo, rappresenta bene come Neutrino sia un cattivo maestro (oca, è un insulto o una considerazione lecita in un duro confronto?)
La termodinamica statistica è sperimentale come la calorimetria, perché sperimentali sono i dati spettroscopici che le sue equazioni elaborano. Neutrino Le ha dato l’illusione funesta che la termodinamica statistica sia uno strumento teorico potentissimo che risolve richieste di termodinamica prescindendo da dati sperimentali. Le dico di più, la termodinamica statistica occupa con eleganza molte caselle delle Tabelle JANAF.
Ora però mi chiamano a pranzo.
Ne riparleremo, prepari le domande, così è più facile per me capire dove ci sono difficoltà.
“oca, è un insulto o una considerazione lecita in un duro confronto?”
Dipende dal contesto e più dalla connotazione in cui vendono delle le cose, ovviamente.
1) Per Lei ha senso un’ipotesi di questo tipo; I dati sperimentali sono necessari a verificare se i modelli e le equazioni matematiche sono esatte.
Per me le cose stanno cosi, i dati devono essere raccolti per facilitare il lavoro degli sperimentali e per supportare come verifica il lavoro dei teorici, si crea un modello e lo si confronta con i dati sperimentali se c’è congruenza il modello può essere usato per fare altre predizioni, altrimenti si corregge.
2) Si possono fare delle ipotesi puramente teoriche ed arrivare a risultati comunque congrui con quelli sperimentali?
Per me si, ci si può arrivare, il tutto sta nel fare le ipotesi giuste e nell’avere gli strumenti matematici giusti, è capitato più di una volta che strutture matematiche sviluppati come puro esercizio intellettuale poi si siano dimostrati strumenti eccezionali per la fisica e la chimica.
3) Buono o cattivo maestro, per me un buon maestro è quello che insegna a ragionare ai propri studenti e li incoraggi ad usare la propria testa, insegna i principi del metodo scientifico e li incoraggia ad esplorare nuove idee ed ipotesi, non trascurando però il rigore e ciò di quanto già
consolidato, un esempio è stato Fermi, un insegnante rigoroso, ma un pomeriggio a settimana dava spazio al libero sfogo di ipotesi ed idee sui e dei suoi studenti, e chissà come mai tante idee
nuove sono nate cosi, per quanto ne so in molte università americane il modello è stato copiato.
Il cattivo maestro per me, ed ammetto ne ho avuti, sono quelli che oramai hanno perso la voglia di insegnare, bravi magari, ma che oramai hanno perso l’entusiasmo e la voglia di trasmettere quanto sanno, con quelli lo ammetto non sono mai stato tanto bravo nelle materie insegnate da questi.
@Gabrichan
Stiamo attenti a non allargare i termini della questione che resta questa:
Lei ora ha spostato la Sua attenzione su un punto generico:
In altre parole, in genere si propone un modello matematico e si cerca una conferma sperimentale, un metodo classico che vale per chimici, fisici, tutti. Neutrino invece concede al suo privato modello matematico un’autonomia che non merita e che è risultata in questo grafico arcobaleno, non commentato e che mai commenterà, perché non sa cosa dire.
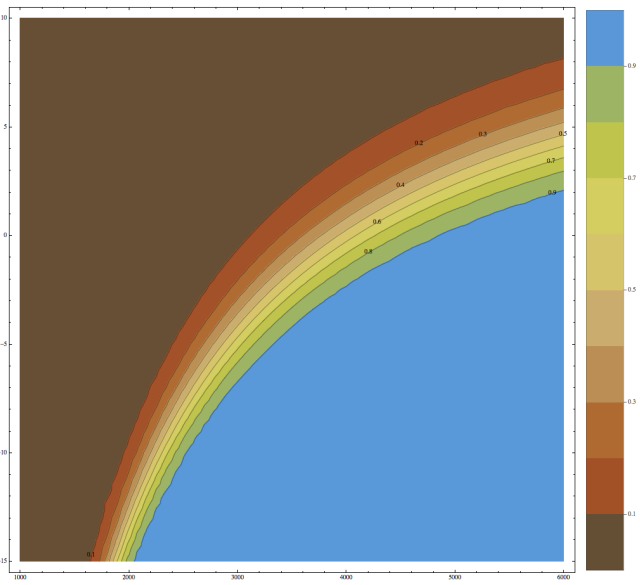

Noto che nessuno di voi ha chiesto che cosa ha prodotto. Vi sta bene perché è colorato?
Spesso Neutrino abbandona le sue creature in mezzo al guado, compresa questa equazione, che assomiglia a quelle di Stevenson e di Hales, ma non è:
L’atteggiamento di chi crede di volare alto senza avere le ali.
Non ha il controllo della situazione, perché scrive con atteggiamento critico:
In realtà era Neutrino a voler prescindere dalle Tabelle JANAF, peraltro costruite anche con l’apporto della termodinamica statistica, ossia con dati spettroscopici. Attribuisce agli altri quello che un minuto dopo fa lui stesso:
La realtà è che le Tabelle JANAF sono cadute come un fulmine a ciel sereno tra fisici e ingegneri. Giancarlo le aveva scambiate non so che altre tabelle. E Giancarlo è Giancarlo, non è Neutrino. Giancarlo ha la prudenza di un ingegnere, che manca a Neutrino.
Comunque se Neutrino viene considerato un buon docente mi rallegro con lui. Ma almeno si sa se è davvero docente o uno dei tanti Celani che stazionano a Frascati e che frequentano i Violante dell’ENEA?
Ora Neutrino farebbe bene a occuparsi del tetrossido di azoto con un modello teorico che tenga conto della tremenda “realtà” di quei gas, che non può contrabbandare come ideali. Dirà che si tratta di foutaise, di un equilibrio di nessun interesse.
A risentirci, vado al mare con gli altri.
@Neutrino
Li leggo e li capisco purtroppo. Non ho commentato le tue fatiche teoriche per non farti male, ma tu mi costringi.
il tuo topolino:
L’equazione che tu e FermiGas avreste dovuto utilizzare è questa:



in genere non si va oltre a, b, c; se è necessario è possibile farlo i dati sono tabulati. Non sto a spiegarti che cosa sono a, b, c perché te lo assegno come compito per casa.
Altro che “campionare con matita e righello il grafico di camillo”.
Anche prendendo questa tua relazione non ci siamo:
Secondo te ε sarebbe la variazione standard di entalpia standard per la H2 —> 2 H? Ma Gabrichan è convinto che tu non faccia uso di dati sperimentali; uno compare già bello vistoso dopo il segno di uguale.
R1 = R, costante dei gas? Perché il pedice? Se non spieghi quello che hai inteso fare passo passo, nessuno ci capisce niente, specialmente oca sapiens.
Se non ti metti in testa che per fare delle chimica bisogna essere chimici, sarai sempre un pessimo esempio per chi ti legge, soprattutto per oca sapiens, bravissima in fisica ma non in chimica, Gabrichan e soprattutto per gli studenti di fisica.
Ti avevo chiesto di presentare questo diagramma che FermiGas ha costruito per te:
evidentemente non ti piace più, anche se assomiglia all’arcobaleno. Ma vedo che anche a oca sapiens interessa pochissimo, perché non se ne è mai occupata. Nel prossimo post ci farebbe un figurone.
C’è una morale da trarre come nelle favole di Esopo. Se all’INFN per le esigenze di chimica ci si affida a fisici, il rendimento di tutta la baracca sarà modesto.
Comunque fa piacere che in tanti abbiano scoperto una forte passione per la chimica. Si convincano però che si impara solo a scuola.
Neutrino, non offenderti se non leggo più i tuoi parti scientifici di termodinamica chimica.
@Cimpy
Mi dispiace sinceramente di avere perduto il Suo consenso, perché la considero una persona acuta e spiritosa.
E’ rimasto colpito dalle conoscenze di termodinamica chimica di Neutrino? Come oca mi considera arrogante se scrivo che Neutrino è un pessimo maestro?
@Cimpy
Secondo Lei, quanti sono in tutti blog quelli che sanno occuparsi di termodinamica chimica?
Ha idea di quanti sarebbero intervenuti per difendere Neutrino, un personaggio molto popolare, se avessero saputo come intervenire? E’ già un successo se riesco a diffondere qualche conoscenza di Chimica. Rispondere a Gabrichan è qualcosa di più che mi sembra utile.
Stimo molto Gabrichan perché con lui si lavora a domande e risposte. Se tutti fossero come lui, i blog sarebbero molto utili per diffondere qualche conoscenza. Fa le sue osservazioni e aspetta un commento, che non sempre so fornire in modo soddisfacente, ovvio.
Purtroppo il blog di ocasapiens si è inzeppato di tifosi, indignati perché scrivo che Neutrino è un cattivo maestro. Diventato di colpo infrequentabile, se non per estrarre gli interventi di Neutrino. Ho provato a rispondere a Psicopompo, ma non mi sembra il caso, non sa letteralmente nulla, tranne cose psichiche, che detesto. Da lasciare a ocasapiens con grande entusiasmo. Lei lo trova ok.
Cerco di fare conoscere un po’ di chimica, anche se è difficile partire da zero.
Credo che il tifo per Neutrino dipenda dal fatto che molti dei tifosi lo conoscono.
@Neutrino
mi era parso di ricordare che Tinypic fosse di FermiGas, controllerò, ma che importa.
Insomma che cosa rappresenta quell’arcobaleno? Ci voleva molto a tararlo?
Pingback: Camillo, c’è posta per te – Ocasapiens - Blog - Repubblica.it
Camillo,
Dia retta: finiti i mondiali e con l’estate alle porte è bene alleggerire glia animi !
Tenga fede al nome del blog: ripartiamo con una gara di onanismo mentale su e-cat e fantomatici report di terze parti.
Vedrà che rifiorir di commenti
Sarebbe un bella pausa balneare ! Poi, a settembre, con la tensione che sale in merito al report, qualche post indigesto come gli ultimi due riesce a passarli!
con imperitura stima.
Tiziano
Tiziano
Sarà una questione di gusti, ma confrontarmi con Neutrino è mille volte più divertente che occuparsi di mamozi, che tanto non scappano. E’ come con le telenovelas, puoi entrare alle cinquantesima puntata e capire tutto.
@Neutrino

la sola presentazione che hai fornito della tua orribile equazione
è questa:
Ci sono addirittura due costanti dei gas ideali R e R1.
Una autentica presa per i fondelli. Sciatteria pura.
Ci stai prendendo per coglioni. Tutto per fare felice oca sapiens.
@Camillo
Io non ho ancora capito contro cosa sta combattendo. La ricerca di misure sperimentali è sempre andata di pari passo con la ricerca di una loro possibile modellizzazione. Cosa ci trova di strano?
@Mahler
Che sia difficile capire di che cosa si tratta per chi non è chimico l’ho capito leggendo i commenti di oca sapiens e di Cimpy.


In soldoni si tratta di questo.
Limitando il nostro interesse alla dissociazione termica dell’idrogeno, essa è descritta da questa equazione:
dove figurano grandezze sperimentali, a cominciare dall’entalpia standard di formazione di una mole di atomi di idrogeno per dissociazione della molecola.
Ovviamente l’equazione ha validità generale e si applica a tutti gli equilibri gassosi. Noi la usiamo per l’idrogeno.
Neutrino non fa modellizzazione ma propone una sua orrida equazione alternativa:
così presentata:
Per senso di responsabilità credo sia necessario respingere con fermezza i dilettantismi chimici di un fisico dell’INFN, che probabilmente è in contatto con studenti di fisica e li può influenzare.
Si capisce la pericolosità di certe uscite in materie sconosciute dalla reazione da due o tre tifosi di Neutrino, che non hanno conoscenze di chimica ma entrano con passione nel merito.
Non ho idea di chi sia Neutrino e che posizione occupi in INFN, ma vedo che è uno che tenta di intimidire con una scienza che non possiede. Se si aggiunge che forse è amico personale di alcuni dei commentatori, si capisce la difficoltà di contenerlo. Basta mantenersi tranquilli e alla fine tutto si risolve.
Per me è una bella dimostrazione della mia tesi che difficilmente si può fare qualcosa di utile quando si esce dal proprio campo di studi. Giancarlo commenterà ribadendo che esiste una gaussiana che rende possibile a un veterinario o ad oca sapiens di fare della chimica innovativa. Ognuno ha le sue opinioni.
Per quanto mi riguarda mi atterrò con la massima fermezza alla mia decisione di scrivere solo di argomenti chimici, dove solo un chimico mi può contrastare, non certo un fisico dell’INFN.
Neutrino ha preso cappello e preferisce commentare in un altro blog dove tutti lo ammirano.
Se questa è l’aria che tira all’INFN, la vedo brutta con le interrogazioni parlamentari. Forse Celani è il più bravo di tutti. E comunque lupo non mangia lupo.
@Mahler
Aggiungo a quanto ho scritto questa mattina verso le 6, che non aiuta il fatto che tutti quelli che partecipano ai blog hanno delle ottime conoscenza di fisica, mentre praticamente nessuno ha conoscenze di chimica. I più preparati fanno riferimento con orgoglio alle 70 – 80 ore di lezione dedicate alla chimica quando erano matricole. Dopo è il deserto.
Non si ama ciò che non si conosce, anzi, se ne diffida.
Il corso di Laurea in Chimica comporta una serie di esami di fisica o riconducibili alla fisica.
Quelli che conosco: Fisica 1, Fisica 2, Teoria degli errori e trattamento dei dati (nota ai miei tempi come Fisichetta), Fisica Tecnica, Misure Elettriche, Spettroscopia. Poca roba, ma sempre sei esami indipendenti.
Eppure nessun chimico pretende di conoscere la fisica e si ritira con rispetto di fronte a questioni di fisica, dato che esiste una rispettabile laurea in fisica.
Il contrario non avviene, quindi i Neutrini si incontrano spesso. Io ci sono abituato da quando ero studente. Perché succede? Forse Psicopompo può spiegarcelo.
@Giancarlo
Purché ci si fermi al giudizio dei pari. Basta un niente slittare dal giudizio alla proposta di fare un esperimentino critico e di affidare il tutto a Mario Massa o a un istituto di Fisica Tecnica. A furia di proposte, costruzione di mamozi prototipi, test di controllo, TPC e altre amenità, trascorrono altri anni a danno del contribuente. Abbiamo già dato 25 anni, basta così.
I Fuf italiani, se vogliono, possono estrarre fior da fiore dalla loro produzione scientifica e affidarla a un comitato di chimici e fisici simile all’ERAB del DoE, se esiste. Dieci articoli in tutto. Undici per fare contento l’ultimo arrivato.
Perdonate l’OT, ma trovo vergognoso che un giornale pur di far notizia pubblichi che alcuni ragazzini siano riusciti a fondere a freddo giocando con una cella elettrolitica, dando oltretutto il fenomeno come ben conosciuto dalla scienza.
http://iltirreno.gelocal.it/pistoia/cronaca/2014/02/02/news/a-13-anni-riproducono-la-fusione-a-freddo-1.8591445
@Albir30
Grazie per la preziosa segnalazione.
Bisogna chiedere a Mario Massa di dare un’occhiata.
Ecco a cosa portano i cattivi maestri. Bambini che si considerano scienziati rovinati per sempre. Brava prof di astronomia, bravo ing.
@Camillo
Qualcosa di simile la feci pure io a 13 anni, in terza media. L’ho raccontata tante volte… Io ed il mio amico avevamo capito che non era successo nulla…. ma se avessimo avuto internet, facebook e i vari strumenti “social” forse avremmo amplificato il risultato del nostro gioco….
Cosa non si fa per un po’ di visibilità, prof compresi!!!
Nel 1989 la prof di scienze si fece una risata e la cosa finì lì…
@sandro75k
Veramente la proposta era ironica, non c’è da scomodare nessuno.
@Albir30
Concordo, quell’articolo è scritto da un incompetente e chi lo legge può essere indotto a pensare che la fusione fredda sia una realtà acquisita. Ma su un giornale locale è inutile stupirsi.
Qui: https://www.youtube.com/watch?v=n7WjzYflPYI
è possibile vedere il filmato nel quale i due ragazzi, Matteo e Ivan, che frequentano la terza classe dell’istituto Marconi di Pistoia, mostrano il loro esperimento, certi di avere realizzato una fusione nucleare. E’ probabile che l’artefice vero sia il padre di Matteo, ingegnere.
Non c’è quindi nulla da indagare, si tratta di una delle solite repliche della cella Mizuno, quella a cui si è ispirato anche l’ing. Abundo dell’istituto Pirelli di Roma: utilizzare giovani studenti per farsi notare sembra diventato usuale. Spero che Camillo abbia torto e quei due ragazzi non siano “rovinati per sempre”.
Mi rivolgo, se mai dovesse leggermi, al collega padre di Matteo: se vuole bene a questi ragazzi insegni loro prima di tutto umiltà e sano scetticismo (da σκεπτικός = colui che osserva pensando). Se crede davvero di avere dei risultati, non utilizzi così i ragazzi, ma realizzi (anche coinvolgendo nel modo corretto Matteo e Ivan) un esperimento serio e documentato che possa evidenziare eccessi di calore o fenomeni nucleari. GSVIT è sempre disponibile a verificare gratuitamente realizzazioni, fatte da persone serie e competenti, se apparentemente in contrasto con la fisica nota.
Sarà… ma io sono convinto che oltre alle emissioni elettromagnetiche ci siano anche raggi X e se non schermati possano dare problemi, e se l’esperimento lo fanno dei ragazzini la cosa un po mi preoccupa.
@oca sapiens
Questa perla mi era sfuggita
L’equazione è questa:

ΔHzero, a, b, c sono valori sperimentali, diversi per ogni gas.
Nessuno fisico si sente umiliato se gli si ricorda di non pretendere di conoscere la chimica quanto un chimico. Io so da solo che non devo occuparmi di fisica. Neutrino ha voluto fare il piccolo chimico ed è capitato male.
Ho invitato Mario Massa a non diventare fotografo di asini volanti, un rischio che corre come membro dello GSVIT.
Senza teoria non si fa chimica, se non si vuole procedere a caso come gli alchimisti. Ma a questo punto la cosa diventa troppo complessa per te. Non puoi sapere come si procede in chimica, che probabilmente non hai mai studiato.
Difensore di Rossi? Ho scritto un articolo su Rossi per il CICAP, prima che tu ancora ti raccapezzassi sul mamozio. C’era anche riportata la vicenda Petroldragon.
Tutti siamo informati delle vicende giudiziarie di Rossi, non abbiamo bisogno di leggerlo sul tuo blog.
Vedo che entri nel merito della termodinamica chimica. Una bella prova di fiducia nel fisico Neutrino. Se è riuscito a confondere le idee a te, figurati quanti sono gli studenti che a questo punto non capiscono più in che cosa consista la termodinamica chimica.
Ho ragione a scrivere che Neutrino è cattivo maestro, anche se per te è un insulto da lavare con il guanto di sfida. Per te è stato certamente cattivo maestro.
Noto che hai l’abitudine di forzare la posizione degli altri a tuo vantaggio.
Devi davvero nutrire una forte simpatia per Neutrino. Pizza insieme?
Neutrino, occupandosi di chimica con un chimico, mi sembra uno che apprend le chat a grimper.
OT: Emidio Laureti aveva ragione!? :O
http://sploid.gizmodo.com/nasa-reveals-new-impossible-engine-can-change-space-t-1614549987
@Tutti
Considerato che “Neutrino” ha avuto scarso seguito, forse perché il post era un po’ troppo tecnico, ne approfitto per mettere in evidenza un’equazione di Neutrino che ha richiamato la mia attenzione. Buona lettura di “Neutrino 1”.
Se anche questo post non risulterà interessante, ne approfitterò per proporre altre considerazioni di chimica. A me basta che la gente legga, fossero anche solo cinque persone.
@Camillo
Buongiorno Camillo e bentrovato. Sono stato in un posticino di montagna in Austria praticamente refrattario ai mezzi di comunicazione moderni. Al ritorno ho letto i tuoi commenti e sono caduto in depressione. Prima di partire avevo visto i commenti di un tale Camillo sull’argomento Masiero da ocasapiens e mi chiedevo che cosa spingesse i frequentatori a rispondere a un falso Camillo come se fosse quello vero. Poi, ahimé ho capito che era quello vero.
Lasciamo perdere Masiero e Pennetta per i quali non andrebbe perso neppure un minuto, e consideriamo i seguenti due punti che mi hanno fatto un po’ rizzare i peli:
1) Il tempo nella termodinamica
2) L’entropia di Shannon (in risposta a Giulio Valentino)
1) La termodinamica era una termostatica prima di Gibbs. Per non perdere tempo ti copio la Teccani
La t. classica faceva riferimento a stati di equilibrio; era cioè una termostatica, in cui non compariva la variabile temporale. Lo studio dei processi irreversibili (o processi dissipativi), in cui si verificava una tendenza spontanea a raggiungere uno stato di equilibrio, si limitava al confronto tra stato iniziale e stato finale. In verità, per processi quali la conduzione termica o la diffusione, alcune trattazioni fenomenologiche già descrivevano il loro andamento temporale con leggi di trasporto di analoga struttura…
Se hai voglia puoi leggere tutto l’articolo qui:
http://www.treccani.it/enciclopedia/termodinamica/#
Questo è il punto 1.4
Se procedi al punto 8
8. Termodinamica dei processi irreversibili
Di equazioni che contengono il tempo ne trovi almeno una dozzina. Stanno sulla Treccani, sono equazioni d’avanguardia che non hanno trovato posto sui testi universitari, oppure riflettono il pensiero dei maggiori esperti italiani di Termodinamica? Vorrei il tuo parere.
2) Shannon, sia pure nella versione avanzata ottica, l’ho insegnato per più di 15 anni. Qui purtroppo anche GVDR è incorso in un errore, limitandosi alla somiglianza matematica. La teoria dell’informazione per la parte Missing Information e l’entropia non si somigliano. Sono esattamente la stessa cosa(1). Non c’è nulla che Shannon ci possa dire di più; ma ci dice esattamente le stesse cose. Se ti interessa ti posso ricavare in due righe la Sackur-Tetrode che fece impazzire il povero Gibbs. E dirti pure gli errori clamori commessi e che ancora si tramandano nei libri di testo da te tanto amati a riguardo del processo di assimilazione (mixing of same particles).
Non capisco il tuo chiuderti a riccio e rifiutare ogni forma di crossfertilization (hai idea di quanto spenda la UE per favorire tali programmi?): hai paura che i teorici dell’informazione ti scippino la termodinamica? Tranquillo non gliene frega nulla; hanno solo mezzi matematici più potenti ed hanno incorporato le indeterminazioni della MQ.
(1) In realtà differiscono della costante k, che però ci portiamo appresso come errore da più di 100 anni. Se fisici e chimici avessero misurato le temperature in Joule invece di quei bizzarri Kelvin, l’entropia sarebbe un numero puro e k verrebbe abbandonato. Certo sarebbe divertente sentire le previsioni del tempo che annunciano per il giorno successivo una temperatura di 4 E (-21) Joule.
Se a qualcuno, oltre a Mahler, interessa posso pure andare avanti con Shannon.
Pingback: Temperatura e termodinamica | OggiScienza